[本站讯]近日,药学院沈月毛/李瑶瑶教授团队与基础医学院朱德裕副教授、美国内布拉斯加州立大学化学系杜良成教授合作,在期刊Journal of the American Chemical Society在线发表了题为“Structural basis for medium-chain dehydrogenase/reductase-catalyzed reductive cyclization in polycyclic tetramate macrolactam biosynthesis”的研究成果。硕士研究生谢向前、李凡和穆妍欣为共同第一作者,李瑶瑶教授、朱德裕副教授、杜良成教授和沈月毛教授为共同通讯作者,山东大学药学院为第一完成单位及通讯作者单位。

环化反应在天然产物的生物合成中扮演着重要角色,能够生成多样化的分子骨架,同时增强化合物的结构刚性和生物活性。然而,由亲核试剂介导C-C键形成的还原环化反应目前仍相对罕见。中链脱氢/还原酶(MDRs)是一类广泛存在于所有生物体的氧化还原酶,具有高度保守的蛋白质三维结构。这些酶通常作为NAD(P)H-binding的脱氢酶(Zn+依赖)或还原酶(非Zn+依赖)发挥重要作用。值得注意的是,参与多环大环内酰胺(PoTeM)生物合成的MDRs为首类被发现的环化酶。尽管部分PoTeM相关的MDRs已通过体外酶活和同位素标记得以表征,但支撑其环化活性的结构基础和催化机制仍不清楚。
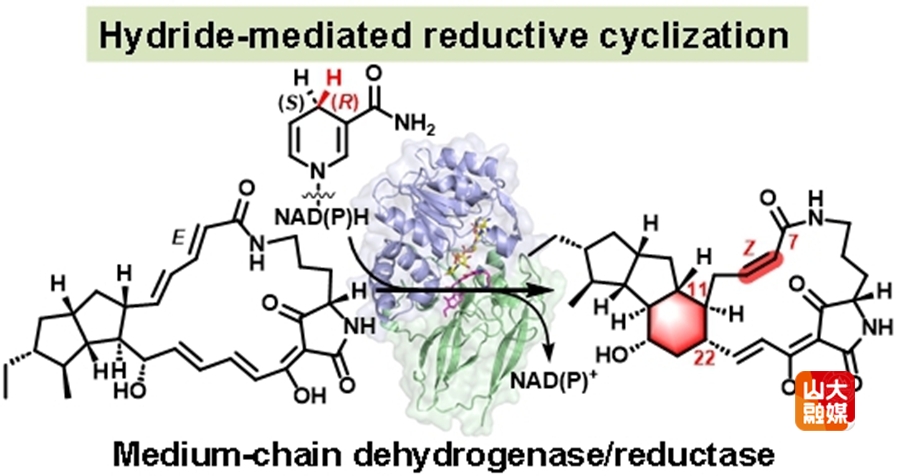
本研究首次解析了PoTeMs相关MDRs家族成员OX4和CftD的apo-及底物复合物结构,并结合突变分析,揭示了其所介导的环化反应机制。我们发现OX4催化反应从NAD(P)H依赖的1,6-还原开始,C7-羰基氧通过水介导的质子化,促使分子内迈克尔加成反应的发生,从而形成C11-C22键,最后通过异构化得到终产物。底物的精确定位以及保守氨基酸W260对烯醇中间体的稳定作用,对于环化反应的顺利进行至关重要。此外,结构比较定位了与底物选择性相关的关键loop区,并通过工程改造实现了CftD的底物选择性改变。这些发现不仅为该类环化酶的结构及催化机制提供了深入理解,也加深了我们对酶促环化过程的认知,对酶工程改造和复杂天然产物的生物合成具有重要意义。
本研究工作得到了国家自然科学基金和山东省自然科学基金的支持。