[本站讯]近日,山东大学基础医学院教授谢玉生,联合新加坡国立大学教授姚少钦、深圳湾实验室教授王蕊、暨南大学教授张志民在Angewandte Chemie International Edition在线发表研究论文“Lysine-targeting, Covalent Inhibitors of Bromodomain BD1 of BET Proteins in Live Cells and Animals”。该研究基于活细胞及动物体内BRDs赖氨酸可配体性全景图谱的系统性绘制,设计开发了首个BET-BD1选择性共价抑制剂BDS4/BDS6。
山东大学基础医学院博士研究生李涛、张文杰、徐广宇,暨南大学王艺清为本文共同第一作者;谢玉生教授、姚少钦教授、王蕊教授、张志民教授为本文的通讯作者,山东大学教授易凡为该工作提供了重要的支持与帮助。山东大学作为论文的第一作者单位和通讯作者单位。
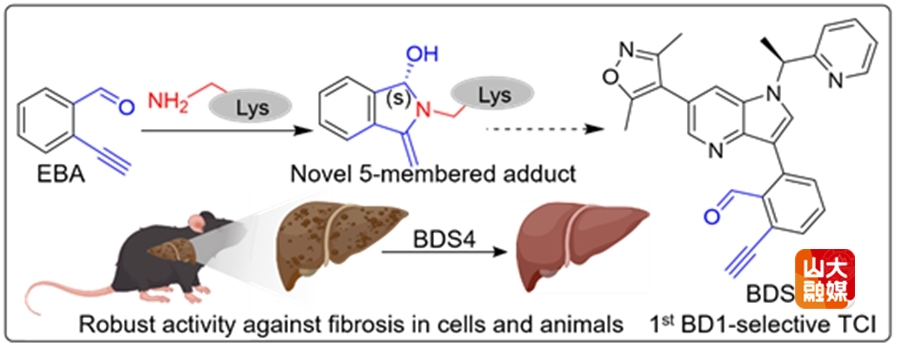
溴结构域(Bromodomains, BRDs)是赖氨酸乙酰化修饰(Kac)的“阅读器”。迄今为止,在人类46种不同蛋白质中共发现了61个BRDs。自其第二亚家族(BET)的首个癌症与炎症抑制剂被报道以来,BET蛋白已成为热门药物靶点。尽管已有多个小分子药物进入临床试验,但这些抑制剂常伴随胃肠道毒性及抗药性问题。值得注意的是,BET包含高度相似(~95%)的串联结构域BD1与BD2,因此,解码BET不同结构域的生物学特性以及开发其单一结构域的选择性抑制剂,已成为突破现有瓶颈的新策略。
本研究基于多类型赖氨酸反应性共价弹头,首先利用邻近标记和化学蛋白质组学技术,在活细胞及动物体内系统性绘制了BRDs的可配体赖氨酸全景图谱。在此关键基础上,利用BET蛋白BD1和BD2结构域活性口袋附近可反应赖氨酸残基之间的差异性,设计开发了不可逆(BDS1-4)与可逆(BDS5-6)两类小分子共价抑制剂。位点质谱与X-ray证实了共价弹头EBA可特异性结合BRD4-BD1的K91位点。其中,BDS4不仅表现出长效抗癌活性,更在细胞和动物模型中展现出显著优于RVX-208(已报道的BD2选择性非共价抑制剂)的抗纤维化效果——后者仅表现出边际效应。可逆共价抑制剂BDS6则为改善药代动力学性能提供了新的策略。该工作体现了化学生物学与药物化学/生命科学的深度融合,所开发的化学工具也为解析BET蛋白BD1与BD2的生物学功能提供了关键手段。
谢玉生课题组长期致力于生物医学与化学生物学的交叉研究,聚焦于基于邻近标记的化学蛋白质组学和小分子药物的发现,相关研究成果发表在Journal of the American Chemical Society、Angewandte Chemie等国际杂志。本研究得到国家自然科学基金项目、山东省优青(海外)项目以及山东省泰山学者青年专家计划等项目资助。