[本站讯]4月22日,山东大学基础医学院于晓教授团队、孙金鹏教授团队、北京大学金长文教授团队以及中科院生物物理研究所王江云教授团队通力合作,在Nature Communications在线发表了题为“Structural studies of phosphorylation-dependent interactions between the V2R receptor and arrestin-2”的研究论文。山东大学基础医学院博士研究生贺庆涛、林婧宇;研究员肖鹏,北京大学医学部博士研究生黄深明、教工贾英丽,中国科学技术大学朱中良老师为本篇论文的共同第一作者;于晓教授、孙金鹏教授、金长文教授和王江云研究员为共同通讯作者,山东大学为该论文的第一单位。
G蛋白偶联受体(GPCR)是目前已知的人类基因组中最大的膜蛋白家族,负责80%左右的跨膜信号转导,参与调控人体中大多数病理与生理过程。GPCR主要通过G蛋白及arrestin将细胞外的刺激转变为细胞内信号。GPCRs招募arrestin之前通常会被GPCR激酶(GRKs)磷酸化,产生不同的磷酸化模式并通过与arrestin作用发挥不同功能。孙金鹏教授与王江云教授研究团队针对受体与arrestin相互作用的磷酸化编码机制展开了一系列的研究工作,发现了GPCR磷酸化编码机制,创新性的提出了受体磷酸化的“笛子模型”理论(Nat Commun6, 8202 (2015)。基于“笛子模型”的理论基础,该合作团队进一步揭示了GPCR磷酸化编码别构调控SH3 domain蛋白的多聚脯氨酸码头分选机制(Nat Chem Biol14, 876-886 (2018))。然而,单个磷酸化位点是如何调控arrestin的构象及功能仍不清楚。
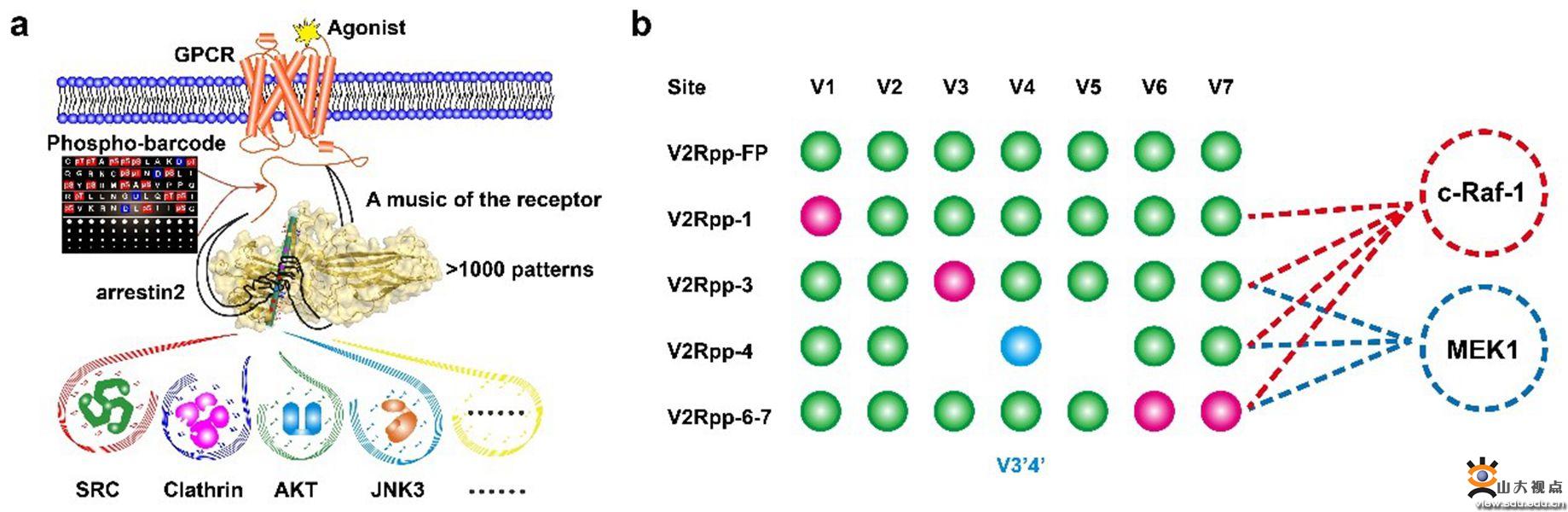
本研究团队利用X-ray晶体学解析了4种不同磷酸化模式的V2R C末端短肽与arrestin的复合物结构,直接说明了不同磷酸化短肽与arrestin2形成不同的作用模式。工作中还意外发现了笛子模型中的新磷酸化编码方式,在arrestin上发现了新的磷酸根结合位点“V3’4’”。这一结果说明Arrestin与受体磷酸化编码的结合方式可能比想象中还复杂,存在磷酸化位点结合的优先次序,某些位置的磷酸化位点结合会决定其他位置是否可以结合,并可能还有未发现的新的磷酸化编码结合位点。同时本团队应用最近新发展的DeSiPher技术(Nat Commun11, 4857 (2020) )发现GPCR单个磷酸化位点缺陷可诱导arrestin与MEK和c-Raf-1相互作用区域产生特异的动态构象变化,这说明GPCR单个的磷酸化位点缺陷可直接影响arrestin远端功能结构域的构型。另外,本团队利用FlAsH-BRET检测了V2R C末端不同磷酸化修饰位点突变引起的受体磷酸化模式差异可不同程度影响arrestin对MEK、c-Raf-1的招募能力。因此,GPCR磷酸化引起激活态arrestin的构型差异可引起arrestin不同的信号传导,调控arrestin发挥功能。
综上所述,本研究团队解析了4种不同磷酸化模式的V2R C端短肽与arrestin的复合物晶体结构,结合DeSiPher和BRET等技术手段,系统说明了GPCR单个磷酸化位点缺陷即可引起arrestin远端功能结构域产生不同的构象变化,并发现了其与arrestin生物学功能的相关性,不仅揭示了GPCR单个磷酸化位点对arrestin功能的调控机制,还发现了磷酸化编码过程中重要的次序原理,是2015年团队提出的磷酸化编码的笛子模型的进一步重要深度阐释和拓展,并在机制方面有了更深入的探讨。
以上研究得到了国家杰出青年科学基金、国家优秀青年科学基金和国家自然科学基金的资助与支持。
原文链接:https://www.nature.com/articles/s41467-021-22731-x