[本站讯]近日,国家糖工程技术研究中心吴选俊教授团队的最新研究成果“A versatile photothermal vaccine based on acid-responsive glyco-nanoplatform for synergistic therapy of cancer”在Biomaterials发表(Impact Factor: 10.317)。吴选俊教授为该论文的通讯作者,博士生高亚楠为该论文的第一作者。山东大学为第一作者单位和通讯作者单位。
癌症是全球第二大死亡原因。2018年全球新增癌症病例1810万例,其中死亡病例960万例,预计到2040年全球将新增癌症病例2950万例,我们迫切需要有效和安全的手段来对抗癌症。疫苗是为预防疾病而研发的最具体、最有效的工具,癌症疫苗的成功开发将是该领域的巨大飞跃,并且契合“健康中国”这一国家战略。然而,癌症抗原的低免疫原性和实体瘤中普遍存在的免疫抑制,给癌症疫苗的研制带来了巨大挑战。
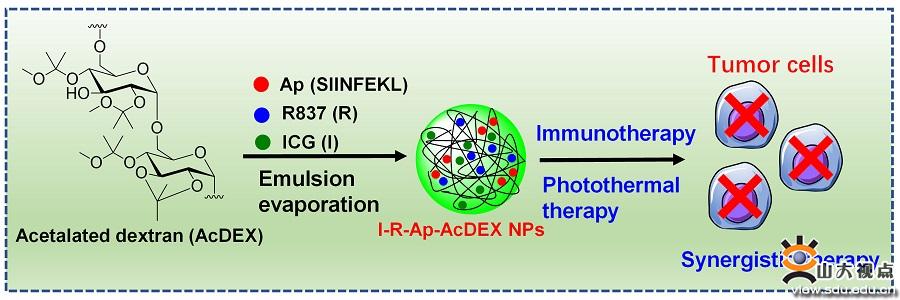
I-R-Ap-AcDEX NPs用于肿瘤光热协同免疫治疗示意图
近日,吴选俊教授团队研制了一种新型治疗性抗癌疫苗新技术,将吲哚菁绿(ICG,简称I)、咪喹莫特(R837,简称R)和外源性细胞毒性T淋巴细胞抗原肽(CTL-Ap,序列为SIINFEKL,简称为Ap)封装在缩醛化葡聚糖纳米颗粒(AcDEX NPs)里,将其形成平均直径为92nm的纳米颗粒作为免疫原用以治疗癌症。结果发现,施用所得多功能疫苗I-R-Ap-AcDEX NPs可大大增强抗肿瘤细胞毒性T淋巴细胞(CTL)免疫疗法的疗效。一方面,首先通过皮下免疫NPs疫苗促使外来Ap进入抗原呈递细胞的主要组织相容性复合物I类(MHC-I)交叉呈递途径,从而呈递Ap并引起高水平的Ap特异性CTLs。另一方面,通过瘤内或静脉注射NPs疫苗又使得Ap进入肿瘤细胞并通过MHC-I交叉呈递途径呈递Ap。Ap特异性CTL可以直接杀死Ap呈递的肿瘤细胞。此外,NPs还能够产生光热效应来进一步杀死肿瘤细胞。据我们所知,这是AcDEX NPs应用于抗肿瘤光热疗法中的首次报道。引人注目的是,通过将NPs疫苗全身给药以及与近红外激光照射相结合的方式,对两种非OVA肿瘤模型小鼠进行治疗时,发现肿瘤完全停止生长。这表明可通过利用光热效应来增强抗肿瘤免疫治疗疗效。这一令人印象深刻的结果,彰显了疫苗I-R-Ap-AcDEX NPs协同治疗的巨大前景。
上述工作得到了国家自然科学基金(22007058)、山东省自然科学基金(ZR2020QB165)、江苏省自然科学基金(BK20200236)、山东大学微生物技术国家重点实验室开放课题(M2020-02)和山东大学齐鲁青年学者项目的支持。
文章链接:
https://doi.org/10.1016/j.biomaterials.2021.120792