[本站讯]2月19日,基础医学院贾木天教授团队在Molecular Cell杂志发表了题为“Asparagine sensing by TBK1 controls its phase separation to drive antiviral innate immune responses”的封面文章。山东大学基础医学院博士研究生杜洁、李超群为共同第一作者,贾木天教授为通讯作者,山东大学为第一作者和通讯作者单位。

在宿主与病毒的长期博弈中,营养物质不仅是双方争夺的核心生存资源,也是调控细胞生理功能的关键信号分子。免疫细胞能够敏锐感知局部营养微环境的动态变化,并据此重塑自身代谢稳态与功能表型。氨基酸作为核心营养物质,在免疫稳态维持及免疫应答调控中发挥不可或缺的作用。然而,免疫反应的关键信号分子如何精确感知免疫细胞内氨基酸的动态变化,进而调控固有免疫应答的分子机制,尚不清楚。

图为Molecular Cell2026.02.19封面:荷叶象征宿主细胞,其上金色粉末代表天冬酰胺,天冬酰胺驱动TBK1形成的液滴犹如荷叶表面的露珠,阳光穿透象征着免疫信号的激活与病毒阴霾的驱散;而叶片枯萎则喻示天冬酰胺耗尽后免疫防御的瓦解。
研究团队通过代谢组学分析发现,病毒感染可引发巨噬细胞广泛的氨基酸代谢重编程。通过对胞内丰度显著变化的氨基酸进行系统性筛选,研究人员锁定天冬酰胺为调控抗病毒免疫应答的关键营养调节因子。功能验证实验表明,天冬酰胺可显著促进DNA病毒与RNA病毒感染诱导的Ⅰ型干扰素(IFN-β)分泌,进而有效抑制病毒复制。进一步的机制研究发现,天冬酰胺可直接调控TBK1的激活,并直接结合TBK1二聚体,驱动TBK1二聚体之间发生交联,进而诱导TBK1发生液-液相分离,形成微米级液滴状凝聚体。该相分离过程可显著提高TBK1的局部分子浓度,促使未磷酸化的TBK1二聚体被招募进入液滴,通过TBK1之间的高效相互作用实现自磷酸化激活。
此外,研究还发现病毒在长期进化中发展出了针对性的进化适应性机制。病毒感染可下调宿主细胞内天冬酰胺合成酶(ASNS)的转录水平,阻断天冬酰胺的内源性合成,在胞内形成“天冬酰胺匮乏”的微环境。这种由病毒主导的“营养剥夺”策略限制了TBK1的相分离与激活,从而实现对宿主固有免疫的“代谢劫持”以逃逸免疫监视。
综上所述,该研究将TBK1定义为一种直接的氨基酸感受蛋白,阐明天冬酰胺作为固有免疫激活“检查点”的新功能。这一发现不仅为理解营养不良或代谢紊乱导致免疫力低下的现象提供了机制解释,也提示靶向天冬酰胺代谢或干预TBK1相分离可能成为治疗感染性疾病、自身免疫病及代谢性疾病的新策略。
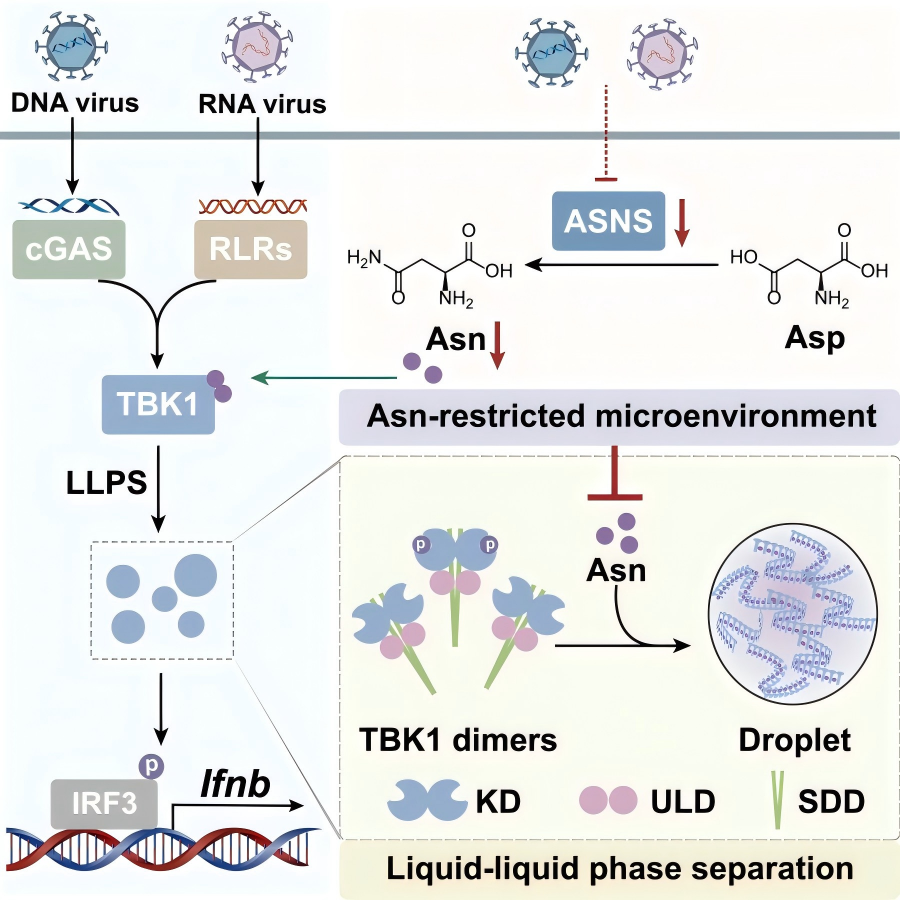
TBK1识别天冬酰胺调控其相分离进而驱动固有免疫激活
贾木天教授团队聚焦“细胞代谢与固有免疫”,重点研究免疫细胞代谢重塑对固有免疫激活的调控机制,揭示感染或炎症性疾病中免疫稳态维持的分子机制,并开发新型免疫调节药物。该研究工作得到国家自然科学基金、国家重点研发计划等项目的资助。