[本站讯]近日,基础医学院韩冰教授团队在微孢子虫病与弓形虫病研究领域取得两项关键突破,两篇研究论文分别以“EnP1 exploits H2Aub-dependent epigenetic reprogramming to promote microsporidia proliferation in host cells”和“Ferroptosis is important forToxoplasma gondiireplication and virulence in vitro and in vivo”为题,发表于中科院一区TOP期刊PLOS Pathogens、Virulence。两项研究分别揭示了微孢子虫通过表观遗传机制调控宿主细胞、弓形虫借助宿主铁死亡途径调控自身毒力的核心分子机理,为两类人畜共患病的精准防控提供了全新理论依据。
微孢子虫病与弓形虫病均为危害严重的人畜共患病,不仅对免疫缺陷人群及胎儿健康构成显著威胁,更给水产、畜牧业生产造成重大经济损失。值得关注的是,微孢子虫可感染健康人群并引发微孢子虫性角结膜炎,近年来已跻身我国公共卫生领域重要新发传染病行列。
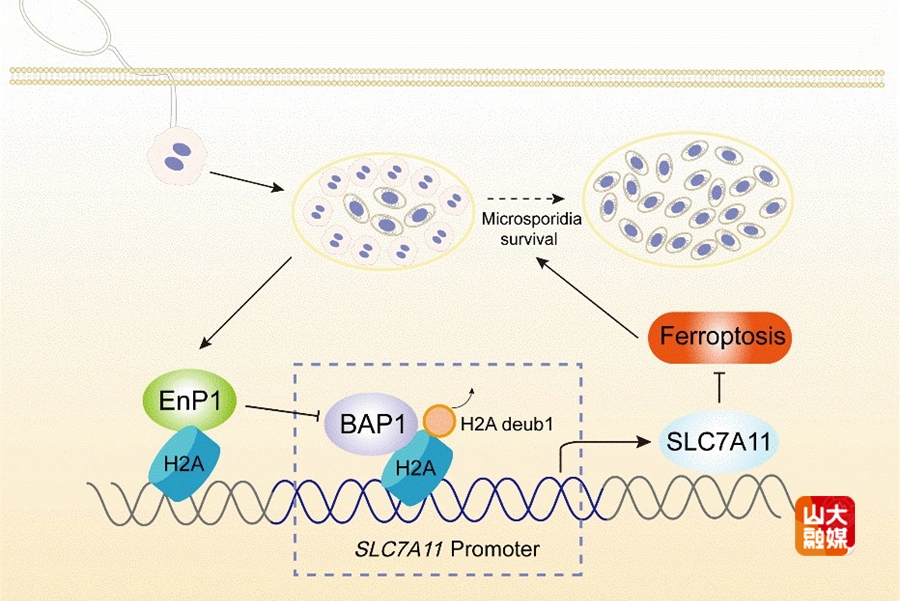
发表于PLOS Pathogens杂志的研究,聚焦微孢子虫关键效应蛋白EnP1的作用机制展开深入探索。该蛋白最初被鉴定为孢壁蛋白,团队前期研究(PNAS,2024年)已证实其为新型核靶向效应蛋白及关键表观遗传调控因子。本研究在此基础上进一步发现,组蛋白H2A是EnP1的新型宿主互作蛋白。实验结果显示,微孢子虫感染或EnP1过表达可通过下调BAP1表达,诱导组蛋白H2A单泛素化修饰(H2Aub),进而调控H2Aub在SLC7A11启动子区域的富集,促进该基因转录,最终通过抑制宿主细胞铁死亡,为微孢子虫增殖与传播创造有利条件。该研究完整解析了EnP1通过H2Aub依赖的表观遗传重编程调控宿主细胞状态的分子通路,显著深化了学界对寄生虫-宿主互作机制的认知。该论文由山东大学基础医学院教授韩冰、青年教师屈虹男担任通讯作者,基础医学院博士研究生关靖宇为第一作者,山东大学为第一作者单位及通讯作者单位。
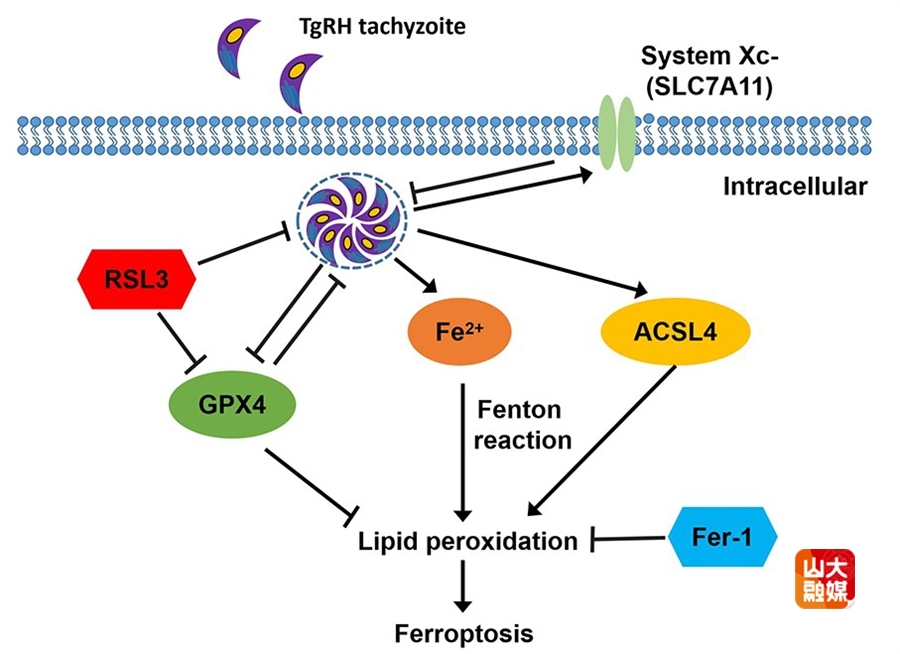
另一项发表于Virulence杂志的研究,围绕弓形虫与宿主铁死亡的相互作用机制开展。该研究首次明确证实,弓形虫感染可诱导巨噬细胞发生铁死亡,并伴随关键分子GPX4表达下调、ACSL4表达上调。进一步研究发现,SLC7A11/GPX4信号轴对弓形虫增殖具有显著调控作用:GPX4抑制剂RSL3对虫体增殖呈现双相效应,而铁死亡抑制剂Fer-1可有效抑制胞内弓形虫增殖,体内实验结果亦验证了这一结论。该研究明确了铁死亡在弓形虫致病过程中的核心作用,同时指出SLC7A11/GPX4信号轴有望成为抗弓形虫药物研发的潜在靶点。论文由山东大学周怀瑜教授、山西农业大学朱兴全教授共同担任通讯作者,基础医学院硕士研究生李玲玉、副教授周春雪、教授韩冰为共同第一作者,山东大学为第一作者单位及通讯作者单位。
韩冰教授领衔的寄生虫致病机制与防治技术团队,长期深耕微孢子虫病、弓形虫病的致病机制解析及临床防治技术研发,相关成果已陆续发表于PNAS、PLOS Pathogens、mBio、Antimicrobial Agents and Chemotherapy等国际期刊。本系列研究得到国家自然科学基金面上项目、博士研究生青年学生基础研究项目、山东省自然科学基金面上项目及山东大学齐鲁青年学者人才计划等多项课题资助。