[本站讯]近日,山东大学齐鲁医院神经外科李刚/薛皓教授团队与山东大学晶体材料国家重点实验室刘宏/仇吉川教授团队携手,多学科交叉合作,提出并构建了一种利用压电纳米刺激器实现对深部脑区进行精准、长效、无线脑深部电刺激(DBS)的神经调控新策略,有效抑制癫痫发作,同时为无线神经调控治疗其他神经系统疾病提供了重要思路。相关成果以“Ultrasound Active Piezoelectric Nanostimulators for Long-Acting Wireless Deep Brain Electric Stimulation to Inhibit Epileptic Seizures”为题,发表于国际材料学顶级期刊Advanced Materials(中科院1区Top,五年IF:28.9)。李刚教授、薛皓教授,刘宏教授、仇吉川教授为共同通讯作者,齐鲁医院神经外科唐琪临、晶体材料国家重点实验室博士研究生李德正为论文共同第一作者。

DBS作为成熟并广泛应用的神经调控技术,已在帕金森病、肌张力障碍、难治性癫痫、抑郁症等多种神经系统疾病的临床治疗中显示出确切效果;然而其为有创手术,且传统电极与极其柔软的脑组织存在杨氏模量错配,在长期生理微动作用下可引发界面微损伤与胶质瘢痕形成。另外,植入式脉冲发生器及皮下连接导线带来额外创伤与感染风险,且电池耗尽后需再次手术更换,增加医疗负担与患者痛苦。作为替代方案的无创神经调控技术(如经颅磁刺激、经颅超声刺激等)虽可避免植入,但空间精度与靶向性有限、总体疗效不够确切,且为获得足够效应常需较高功率,因此限制了设备的便携性。压电纳米材料凭借优异的声—电转换能力,结合超声的深部穿透优势,为实现精准、长效的无线DBS提供了新的可能。
本研究构建了以钛酸钡为核心、聚多巴胺为表层的压电纳米刺激器。聚多巴胺外壳提升了颗粒分散性与稳定性,并赋予其对神经元细胞膜的牢固黏附能力。低强度超声作用下,贴附于膜表面的纳米刺激器输出毫伏级脉冲电信号,直接调控电压门控钙通道,引发神经元兴奋与下游环路激活。机制上,刺激可通过“亚阈值时空叠加”实现有效调控:多次短促脉冲在时间与空间上的累积,使得在传统动作电位阈值以下亦可触发神经元活动,从而以更低能量实现高效神经调控。
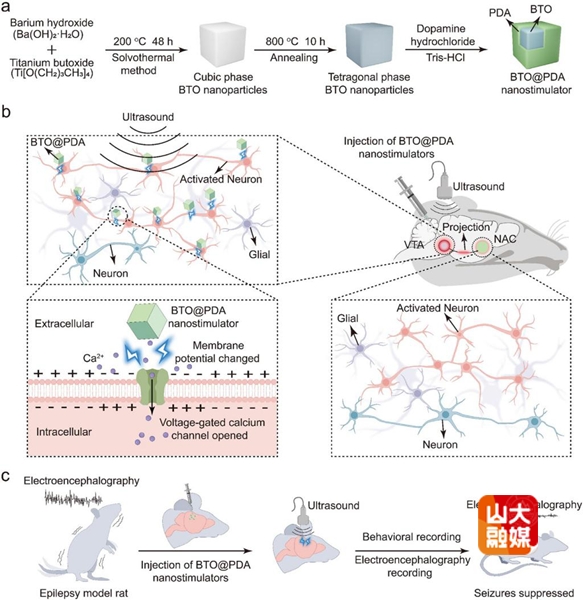
团队通过立体定向微注射将纳米刺激器植入腹侧被盖区、海马CA1等深部脑区,发现纳米颗粒与神经元膜表面紧密邻接且不被内吞,位置在多轮超声后依旧稳定,随访至少14周未见迁移;植入区周围神经元形态完整,胶质细胞激活较传统DBS金属电极减轻,显示出良好的组织相容性与长期安全性。配合便携式低强度超声换能器,该体系在极低声强(0.45 W/cm²)条件下即可实现对深部脑区的有效电刺激;与既往经颅超声常用更高声强(如1.67~2.6 W/cm²甚至更高)相比,显著降低了能量负担并提升了设备便携化与长期应用的可行性。在进一步研究中,研究团队在光遗传癫痫模型、匹罗卡品诱导的急性癫痫持续状态模型及慢性复发模型中,均证实该无线DBS策略对癫痫发作具有稳定而显著的抑制作用。
本研究将超声的深部穿透优势与电刺激的高效神经调控相结合,通过具神经黏附性的压电纳米刺激器实现对深部脑区精准、长效的无线DBS调控,为难治性癫痫的长期管理提供了兼顾安全性与便携性的全新路径,并为拓展至帕金森病、肌张力障碍、抑郁症等功能环路相关疾病的精准治疗奠定了材料与机制基础,展现出广阔的转化前景。
近年来,李刚/薛皓团队与山东大学多个高水平团队在医工交叉领域持续深耕,在神经疾病相关研究及临床转化方面取得系列原创性成果。本研究得到科技创新2030·“脑科学与类脑研究”重大项目、国家自然科学基金、山东省自然科学基金、泰山学者计划、中国博士后科学基金与山东省博士后创新项目等支持。