[本站讯]9月12日,Circulation Research杂志全文发表了山东大学齐鲁医院络病理论创新转化全国重点实验室教授张文程,吴智楠合作撰写的题为“Beyond thevessel wall: Perivascular adipose tissue as a guardian of aorta”评论。
评论内容是上海交通大学医学院附属胸科医院何奔教授团队(现任职于同济大学附属上海东方医院心内科)发表的题为“Lkb1 downregulation links PVAT remodeling to aortic dilation or aneurysm”的研究,该研究揭示了血管周围脂肪组织(perivascular adipose tissue,PVAT)重构或功能障碍在主动脉瘤发生中的重要作用,首次提出主动脉瘤形成的“由外向内(outside-in)”新机制。
评论指出,以往脂肪组织常被视为被动的能量储存结构,但近年研究发现,PVAT实际上积极参与血管功能调控,不仅包裹血管,还可分泌生物活性分子与血管壁进行动态“对话”,调节血管功能与健康。尽管PVAT已被明确为血管稳态和重构的关键调控者,但具体作用机制仍不明了。蔡招华(该研究的第一作者)等人的研究,为阐明PVAT在主动脉瘤发病机制中的核心作用提供了坚实证据,并为治疗主动脉扩张和动脉瘤提供了新的潜在靶点。
由于该研究聚焦于LKB1(肝激酶B1)在PVAT中的作用,评论进一步介绍了LKB1的功能。LKB1是一种进化上高度保守的激酶,参与细胞代谢、能量稳态、细胞极性和肿瘤抑制等多个关键生物学过程。在心血管系统中,LKB1对维持血管稳态具有重要作用,可调控内皮细胞、血管平滑肌细胞及外膜成纤维细胞等多种细胞的功能,然而,LKB1对PVAT这一“血管第四层”的作用尚未明确。该研究首次发现,LKB1在PVAT中高表达,而在血管紧张素II诱导的腹主动脉瘤模型中表达水平显著下降。通过多种类型的细胞(包括成纤维细胞、血管平滑肌细胞和壁细胞)特异性基因敲除小鼠模型,作者证实LKB1缺失会导致PVAT发生病理性重构,表现为褐色脂肪特征丢失,并自发引起主动脉扩张和动脉瘤。这些结果说明,LKB1是维持PVAT正常结构和功能的关键分子,其缺失可导致主动脉结构和功能异常。
评论强调,该研究深入阐释了LKB1缺失的PVAT通过局部肾素—血管紧张素系统(renin-angiotensin system,RAS)异常激活驱动主动脉病变的机制。LKB1缺失促使PVAT中肾素显著高表达,引起局部血管紧张素II水平上升,通过旁分泌作用诱发血管平滑肌细胞功能紊乱、导致主动脉功能失调,形成病理性正反馈循环。另一方面,使用药物阻断肾素或血管紧张素信号通路可有效逆转此类血管异常,凸显了PVAT通过LKB1依赖的代谢和旁分泌机制在主动脉稳态调节中的核心地位。这一发现不仅为理解主动脉疾病提供了“由外向内”的新视角,也为主动脉瘤的诊断与治疗开辟了新途径。
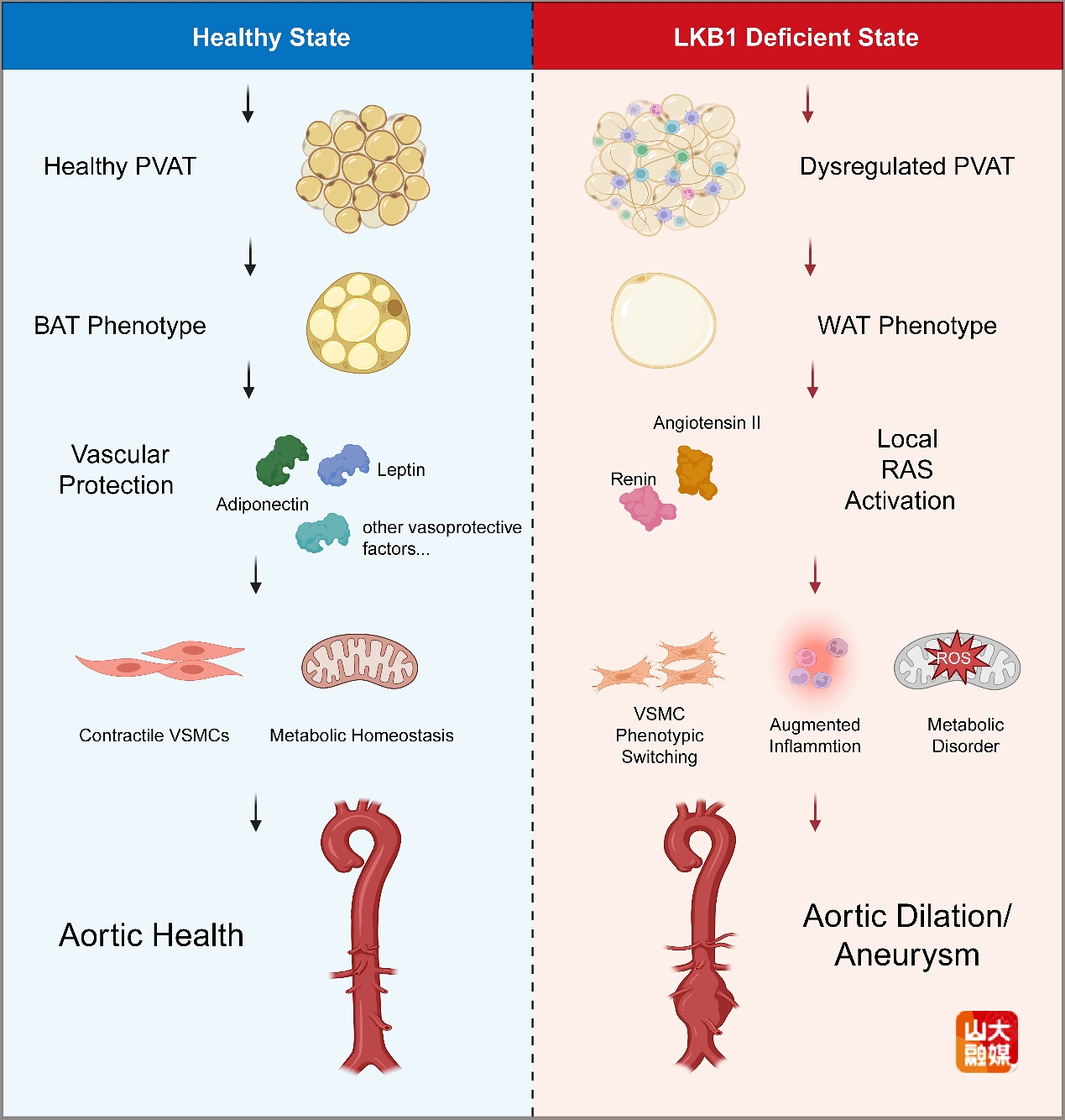
评论最后提出,当前多项研究已明确PVAT是血管稳态的关键调节者和主动脉疾病的潜在诊疗靶点。然而,实现PVAT的相关转化研究仍面临诸多挑战,包括PVAT与血管交互机制的了解不足、缺乏大规模临床研究验证、靶向干预手段有限等。未来需通过深化机制探索、开发PVAT特异性Cre小鼠、发展分子影像技术、构建靶向纳米载体以及制定个体化治疗方案,推动PVAT在主动脉疾病临床管理中的应用。蔡招华等人的研究不仅揭示了PVAT在主动脉疾病中的新机制,而且凸显了通过调控PVAT功能治疗主动脉瘤的广阔前景并拓展了LKB1在心血管保护中的生物学意义,靶向PVAT通路有望在动脉粥样硬化性心血管疾病治疗中发挥重要作用。
LKB1作为主动脉壁的守护者,其功能缺陷会引发PVAT功能障碍和局部肾素-血管紧张素系统(RAS)的过度激活,进而导致血管平滑肌细胞(VSMC)表型转换、进行性主动脉扩张,最终促进主动脉瘤的形成。