[本站讯]近日,山东大学齐鲁医院血液科马道新教授团队在血液肿瘤免疫调控领域取得系列新进展,发现了多个血液肿瘤免疫调控的分子信号通路和干预策略。论文发表在Nature Communications(中科院1区Top期刊,五年IF:16.1)、Molecular Cancer(中科院1区Top期刊,五年IF:31.3)、Leukemia(中科院1区Top期刊,五年IF:10.5)、Cell Death & Disease(中科院1区Top期刊,五年IF:8.6)。
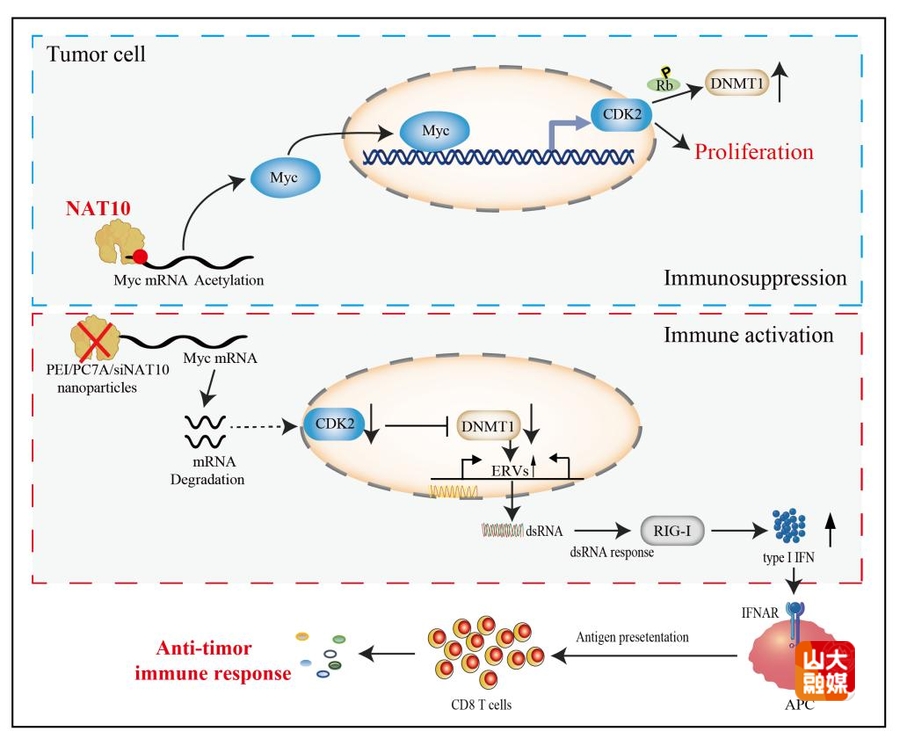
RNA分子的化学修饰在肿瘤生物学中的调控作用日益受到重视,RNA上的N4-乙酰胞嘧啶核苷(N4-acetylcytidine)修饰由目前已知唯一的Writer—N-乙酰基转移酶10(NAT10)催化产生,能够增强mRNA的稳定性并促进翻译效率。研究发现NAT10介导的ac4C乙酰化修饰可调控多种肿瘤细胞的增殖、迁移和侵袭,然而其在癌症进展、宿主免疫调控机制及其靶向治疗的潜在意义仍不清楚。马道新教授团队在Nature Communications期刊发表了题为“Inhibition of tumor-intrinsic NAT10 enhances antitumor immunity by triggering type I interferon responses via MYC/CDK2/DNMT1 pathway”的研究论文。该研究揭示了靶向NAT10在重塑肿瘤免疫微环境的新功能,为对抗肿瘤免疫治疗抵抗提供了新策略。研究发现NAT10在肿瘤组织表达上调,并与免疫细胞浸润程度及总体生存率呈负相关。敲除肿瘤细胞中的NAT10显著增强了肿瘤特异性细胞免疫反应,并抑制了肿瘤生长。进一步机制研究表明,MYC是NAT10下游的关键靶点,NAT10通过增强mRNA的ac4C修饰来调控MYC表达。抑制NAT10会阻断MYC/CDK2/DNMT1通路,从而诱导双链RNA(dsRNA)的形成,进而激活I型干扰素反应,增强体内肿瘤特异性CD8+ T细胞的免疫反应。更重要的是,使用小分子抑制剂Remodelin或PEI/PC7A/siNAT10纳米颗粒抑制NAT10,与PD-1免疫检查点抑制联合治疗,可协同增强抗肿瘤免疫反应,抑制肿瘤进展。该项成果为基于NAT10的免疫干预策略提供了重要理论支撑,并为拓展癌症免疫治疗的新方向以及相关免疫性疾病的治疗开辟了新路径。马道新教授为该文唯一通讯作者,齐鲁医院博士后刘万成、博士研究生魏义洪,中科院苏州纳米所博士后陈锦峰为共同第一作者,山东大学齐鲁医院为第一和通讯作者单位。
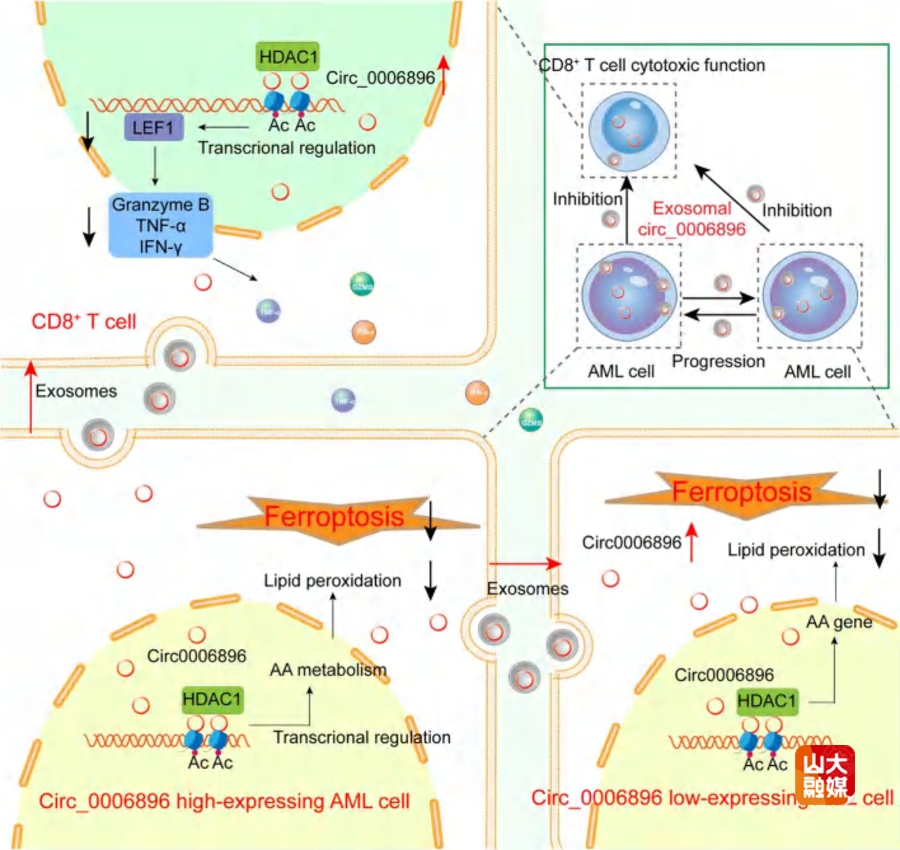
急性髓系白血病(Acute Myeloid Leukemia, AML)是一种具有高度异质性的血液系统恶性肿瘤,容易发生免疫逃逸并且复发。近年来研究发现,外泌体在AML细胞与骨髓免疫细胞之间的信号交流中发挥着关键作用,而环状RNA(circular RNA, circRNA)作为外泌体中重要的非编码RNA成分,在调控肿瘤免疫微环境方面的具体机制尚不明确,具有重要研究价值。围绕这一关键问题,马道新教授团队在Molecular Cancer期刊发表了题为“Exosomal circ_0006896 promotes AMLprogression via interaction with HDAC1 and restriction of antitumor immunity”的研究论文。该研究通过对骨髓外泌体RNA测序,发现了在AML患者骨髓细胞和外泌体中高表达的circ_0006896,其表达量与AML的复发和预后显著相关。体外和体内实验证实,circ_0006896能够促进AML细胞的增殖,减少细胞凋亡并且减弱细胞对化疗药物的敏感性;更重要的是,还发现circ_0006896能够抑制过继性T细胞转移免疫治疗的疗效。机制方面,circ_0006896作为分子支架与组蛋白去乙酰化酶HDAC1的酶催化结构域结合,降低组蛋白H3的乙酰化水平,减少花生四烯酸代谢相关基因的转录,抑制AML细胞脂质过氧化和铁死亡,促进AML进展。此外,外泌体circ_0006896在CD8+ T细胞内,通过与HDAC1相互作用,抑制LEF1转录,降低细胞毒性分子IFN-γ和颗粒酶B的表达,抑制CD8+ T细胞活性,促进AML细胞免疫逃逸。该研究证明了外泌体circRNAs和CD8+ T细胞介导的促进白血病进展的机制,突出靶向circRNAs在AML免疫治疗中的潜力。马道新教授为该文唯一通讯作者,齐鲁医院博士研究生灿灿、杨新雨为共同第一作者,山东大学齐鲁医院为第一和通讯作者单位。
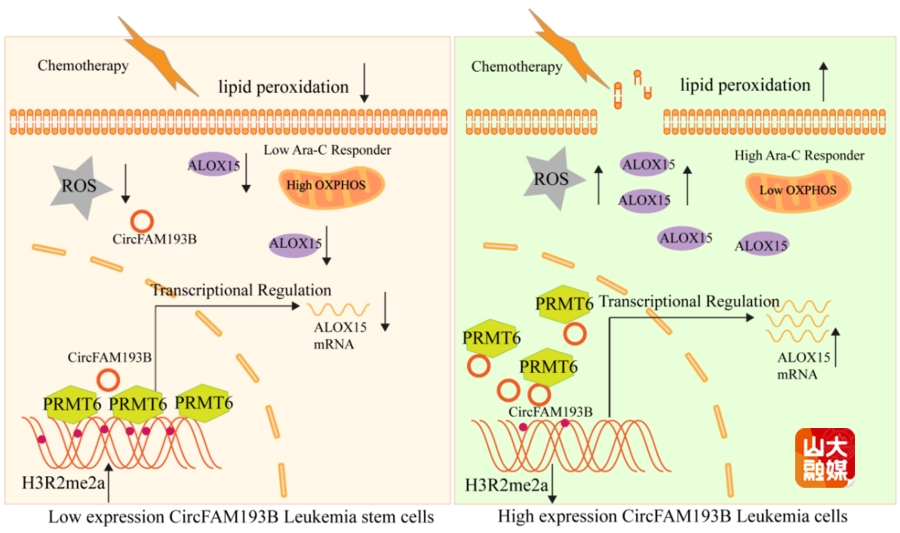
白血病干细胞(Leukemia stem cells, LSCs)的持续存在是导致AML耐药和复发的主要原因,但其发挥作用的具体机制仍不清楚,目前仍缺乏能够从调控LSCs功能、提高其药物敏感性角度出发的有效治疗策略。因此,深入探索AML中LSCs持续存在的分子机制,对于开发新型干预手段、提升患者生存率具有重要意义。基于此,马道新教授团队在Leukemia期刊发表了题为“circFAM193B interaction with PRMT6 regulates AML leukemia stem cells chemoresistance through altering the oxidative metabolism and lipid peroxidation ”的研究论文。该研究发现,circRNAs在相对原始的LSCs中显著降低,提示其在造血细胞分化及白血病的发生发展中可能发挥重要作用。进而,该研究全面探究了circRNAs对LSCs的干性维持及其化疗耐药的调节机制。首先通过circRNAs芯片检测,描绘了AML LSCs的circRNA差异表达谱,筛选鉴定出在LSCs中表达下调的一个全新的circRNA(circFAM193B),发现circFAM193B可以通过调控能量代谢和氧化磷酸化的平衡,来抑制LSCs引起的化疗耐药。其作用机制主要为circFAM193B与精氨酸甲基转移酶PRMT6结合后,通过降低H3R2me2a的修饰,增强了关键脂氧合酶ALOX15的转录,进而促进LSCs的脂质过氧化,提高其化疗敏感性。该研究从circRNA调控LSCs的全新角度进行深入探讨,为AML耐药的靶向干预和治疗提供了新的理论和方法学基础。马道新教授为该文唯一通讯作者,齐鲁医院博士研究生杨新雨为第一作者,山东大学齐鲁医院为第一和通讯作者单位。
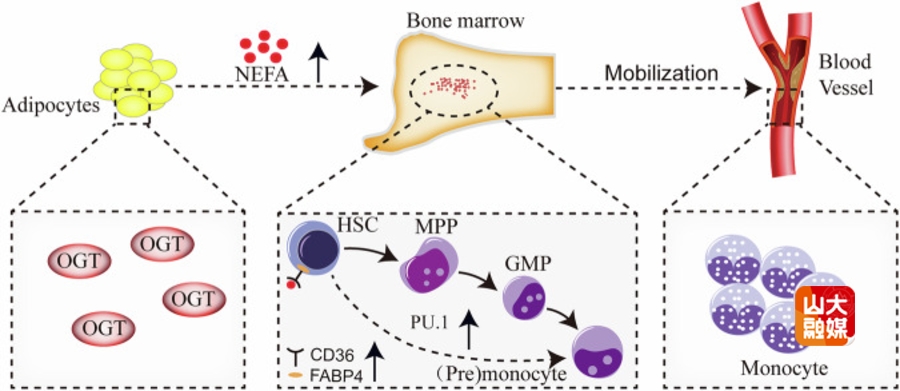
造血干细胞(Hematopoietic Stem Cells, HSCs)与骨髓免疫稳态与多种血液肿瘤有关。肥胖已成为全球公共卫生问题,与血液系统恶性肿瘤密切相关,但其通过免疫与造血交叉调控血液系统的机制仍不明确。此前有研究发现,肥胖患者外周血单核细胞水平显著升高,但其机制不明。马道新教授团队发表于Cell Death & Disease的研究成果“Adipocytes regulate monocyte development through the OGT-NEFA-CD36/FABP4 pathway in high-fat diet-induced obesity”揭示了肥胖影响单核细胞分化的新机制。研究团队通过对1671名成年人的临床数据分析发现,体重指数(BMI)与单核细胞数量呈独立正相关,且高脂饮食(HFD)小鼠模型中也观察到类似现象。进一步实验表明,脂肪细胞中O-GlcNAc转移酶(OGT)基因的表达上调是单核细胞增多的关键驱动因素。研究团队利用脂肪细胞特异性OGT基因敲除(OGT-AKO)小鼠模型发现,OGT缺失显著降低血清非酯化脂肪酸(NEFA)水平,并抑制HSCs向单核细胞的分化。机制研究表明,NEFA通过激活HSC表面的脂肪酸转运蛋白CD36和脂肪酸结合蛋白FABP4,促进单核细胞发育相关转录因子PU.1的表达,最终导致单核细胞数量增加。该项研究首次揭示在高脂饮食诱导的肥胖中,脂肪细胞通过OGT调控NEFA分泌,进而激活CD36/FABP4信号通路,促进HSCs向单核细胞分化的分子机制。该研究还明确了脂肪细胞通过代谢-免疫交叉调控影响造血系统的具体路径,为肥胖相关炎症性疾病及血液肿瘤(如急性单核细胞白血病)的治疗提供了新思路。马道新教授、天津医科大学总医院教授董喜凤为该文的共同通讯作者,山东大学博士后何娜为第一作者,山东大学齐鲁医院为第一通讯作者单位。
马道新教授团队长期致力于血液肿瘤的发病机制、精准治疗、分子靶向和临床转化等领域的研究,取得了一系列高水平的研究成果,相关成果已在Nature Communications、Molecular Cancer、Leukemia、Cell Death & Disease、Blood Cancer Journal等高水平学术期刊上发表SCI论文60余篇,授权相关发明专利3项,获得多项教育部及山东省科技奖励。