[本站讯]近日,山东大学齐鲁医院心血管内科、络病理论创新转化全国重点实验室在血管疾病的研究中取得系列重要成果,张文程教授团队在中科院1区TOP期刊Circulation Research(IF=20.1)、张澄教授/张运院士/张猛教授团队在中科院1区TOP期刊Kidney International(IF=19.6)、张群业教授团队在中科院1区TOP期刊Carbohydrate Polymers(IF=11.2)发表系列论文,进一步阐明了血管钙化和动脉粥样硬化等重大血管疾病的发病机制和干预靶点。
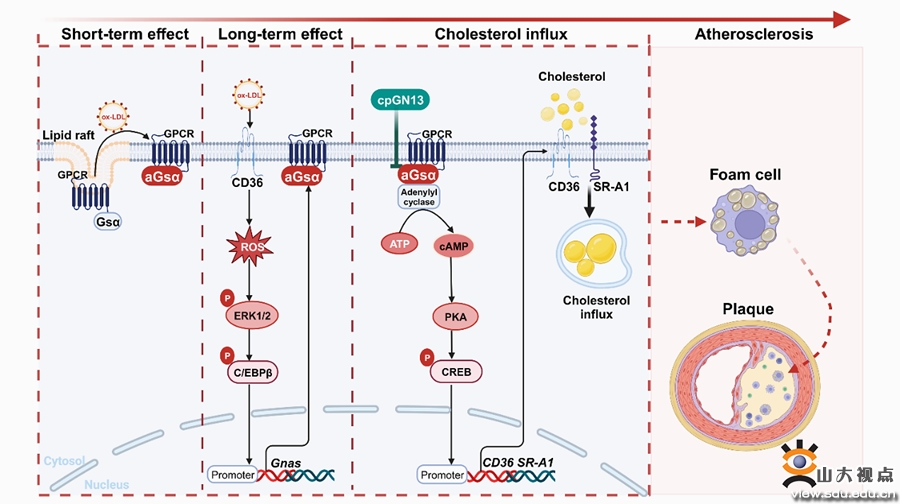
G蛋白偶联受体(GPCR)是成员最多的一类膜蛋白家族受体,通过偶联下游异源三聚体G蛋白将信号从胞外传递至胞内。其中,Gs蛋白α亚基(Gsα)激活后可诱导环磷酸腺苷(cAMP)的产生,参与调节细胞的多种生理活动和物质代谢。然而,巨噬细胞Gsα在泡沫细胞形成和动脉粥样硬化中的作用尚不明了。课题组首先通过对单细胞测序数据集GSE116240进行分析,发现巨噬细胞Gsα参与了胆固醇代谢和泡沫细胞的形成。课题组继之收集了动脉粥样硬化的小鼠斑块样本和临床患者样本,发现随着动脉粥样硬化斑块的进展,巨噬细胞中Gsα的表达和激活水平显著升高。进一步研究发现,Ox-LDL可通过不同的作用机制激活Gsα。Ox-LDL短期刺激可促进Gsα从脂阀结构易位,长期刺激可通过氧化应激介导ERK1/2激活及C/EBPβ磷酸化而促进Gnas基因的转录。巨噬细胞特异性敲除Gsα可抑制小鼠动脉粥样硬化的发展。在机制上,Gsα通过cAMP/CREB介导的转录过程调节CD36和SR-A1的表达,从而在泡沫细胞形成和动脉粥样硬化进程中发挥重要作用。苏拉明和环肽cpGN13通过抑制Gsα的激活,可抑制泡沫细胞的形成和动脉粥样硬化的进展。这些发现首次揭示了巨噬细胞Gsα在动脉粥样硬化中的重要作用,阐明了Gsα的新功能,为动脉粥样硬化治疗提供了潜在的新策略。该研究成果近日发表于Circulation Research,山东大学齐鲁医院心血管内科张文程教授为该文的通讯作者,博士生马畅为该文的第一作者,山东大学齐鲁医院为该文的第一和通讯作者单位。
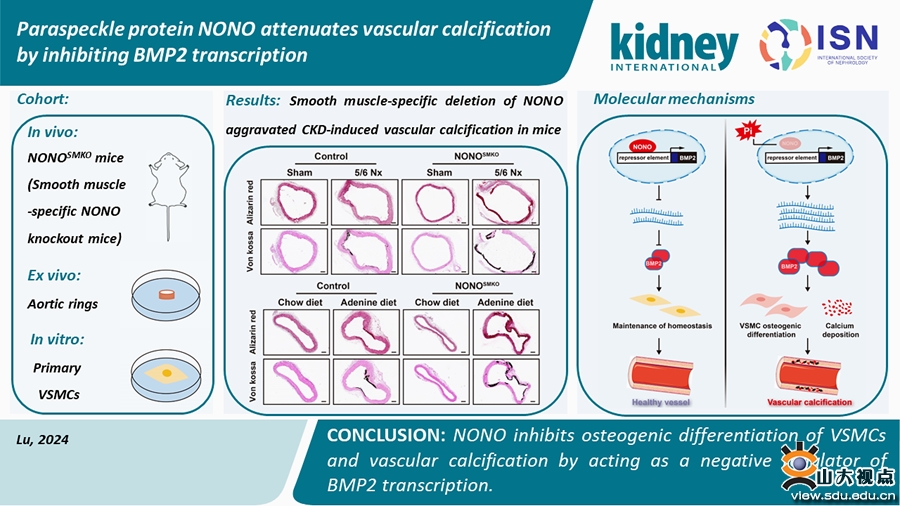
血管钙化是指矿物质以磷酸钙的形式异位沉积到血管组织的病理过程,常见于动脉粥样硬化、慢性肾脏病(CKD)、糖尿病和老年患者中。血管钙化已成为CKD患者心血管发病率和死亡率的独立危险因素,探讨血管钙化的发病机制和干预靶点具有重要的临床意义。旁斑蛋白NONO作为DNA/RNA的结合蛋白,在基因调控中发挥着广泛的生物学功能。既往研究表明,NONO通过抑制P4Hα1的表达影响胶原的成熟与分泌,提示NONO与血管细胞外基质(ECM)的重构存在一定联系,然而在ECM重构相关性疾病血管钙化中,NONO的作用尚无报道。张澄教授领导的课题组发现,CKD患者钙化的冠状动脉中NONO表达减少,同时CKD小鼠及高磷刺激的血管平滑肌细胞(VSMC)中,NONO表达水平均较对照组明显下降。为了明确NONO在血管钙化发生和发展中的作用,课题组构建了血管平滑肌细胞(VSMC)特异性敲除NONO(NONOSMKO)小鼠,并在NONOSMKO小鼠和同窝对照小鼠中分别构建了CKD诱导的两种血管钙化模型和皮下注射维生素D诱导的急性血管钙化模型。结果显示,VSMC特异性敲除NONO加重了钙化小鼠主动脉的钙盐沉积、VSMC成骨分化和凋亡。在体外实验中,课题组发现NONO敲除可加重高磷诱导的VSMC成骨分化、凋亡和钙盐沉积,而过表达NONO可显著减轻这一现象。为了深入研究NONO调控VSMC成骨分化和血管钙化的具体机制,课题组进行了转录组测序,并筛选出关键分子BMP2。双荧光素酶报告基因实验和染色质免疫共沉淀实验结果显示,NONO通过其羧基端与BMP2启动子上的CATAAAT序列结合来抑制BMP2的转录,从而减轻了VSMC的成骨分化和血管钙化的进展。这一发现表明,NONO作为负调控因子在血管钙化中发挥了重要作用,为血管钙化的预防和治疗提供了新的靶点。该研究成果近日发表于Kidney International,山东大学齐鲁医院心血管内科张澄教授、张运院士和张猛教授为该文的共同通讯作者,博士生卢悦为该文的第一作者,山东大学齐鲁医院为该文的第一和通讯作者单位。
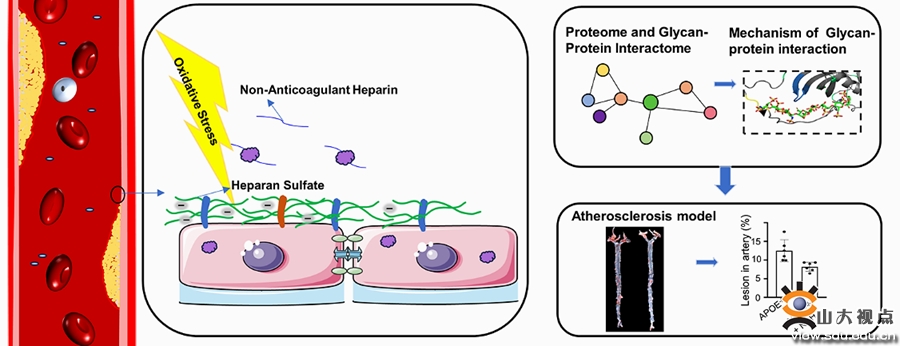
氧化应激引起的内皮功能障碍是引发动脉粥样硬化的早期因素。作为维持血管内皮细胞生物学功能的屏障,内皮细胞表面糖萼富含硫酸乙酰肝素(HS),其生物学功能与糖和蛋白的相互作用密切相关。然而,动脉粥样硬化发生和发展过程中,糖萼损伤及糖萼中HS与蛋白相互作用的机制尚未阐明。山东大学国家糖工程技术研究中心迟连利教授、齐鲁医院心血管内科张群业教授及国家糖工程技术研究中心靳岚教授团队对这一重大问题进行了合作研究。课题组建立了一种检测疾病相关硫酸乙酰肝素结合蛋白(HSBP)的新策略,通过蛋白质组学和糖-蛋白相互作用组学的联合,解决了这一长期被忽视的问题。课题组利用基于液质联用的定性和定量分析技术,揭示了氧化刺激时内皮糖萼中HS结构的变化,采用iTRAQ标记定量蛋白质组技术,比较了氧化刺激对内皮细胞蛋白组学水平的影响,结合人类蛋白组芯片获得的蛋白-肝素相互作用组分析,筛选出一系列受氧化刺激扰动的HSBP。通过生物信息学分析发现,AHSG是动脉粥样硬化过程中一种重要的HSBP。通过核磁滴定技术、基于质谱的氢氘交换技术和分子模拟对接技术,鉴定了AHSG与肝素结合的结构域。体内和体外实验证明,在氧化应激过程中,肝素类似物可保护HS免受降解和减少损伤部位AHSG的积累而缓解动脉粥样硬化。这一研究揭示了肝素/HS通过与AHSG相互作用而发挥抗动脉粥样硬化作用的分子机制,为理解动脉粥样硬化过程中糖萼HS的重要作用提供了新的见解。该研究成果近日发表于Carbohydrate Polymers,靳岚教授、张群业教授和迟连利教授为该文的共同通讯作者,山东大学博士生陈晴晴和徐晓晖为该文的共同第一作者,山东大学国家糖工程技术研究中心和齐鲁医院为该文的并列通讯作者单位。