[本站讯]近日,海洋学院陈景帝教授团队利用双模板诱导界面组装法,成功制备具有空腔尺寸可调的卵黄壳磁性介孔聚多巴胺囊泡以增强光热抗菌作用,并进一步揭示其界面组装和聚合机理。研究成果“Dual-template Induced Interfacial Assembly of Yolk-shell Magnetic Mesoporous Polydopamine Vesicles with Tunable Cavity for Enhanced Photothermal Antibacterial”发表在国际化工领域权威期刊Chemical Engineering Journal(中科院一区,影响因子15.1)。山东大学海洋学院教授陈景帝、上海大学教授苏佳灿,电子科技大学研究员岳秦为该论文共同通讯作者,山东大学助理研究员潘盼盼为本论文第一作者,山东大学为第一完成单位。
具有大空腔、可移动磁芯的蛋黄壳磁性聚合物纳米结构是各种应用中客体分子大量存储、释放和运输的有效载体。然而,由于缺乏定制的纳米结构,以受控方式实现客体物质进出中空空间的可控传输仍然是巨大的挑战。
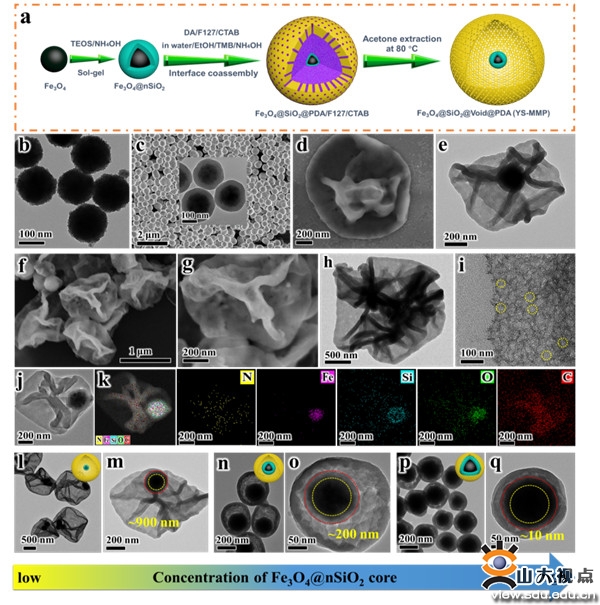
图1 蛋黄壳磁性介孔聚多巴胺囊泡(YS-MMP)的合成方法及表观形貌图
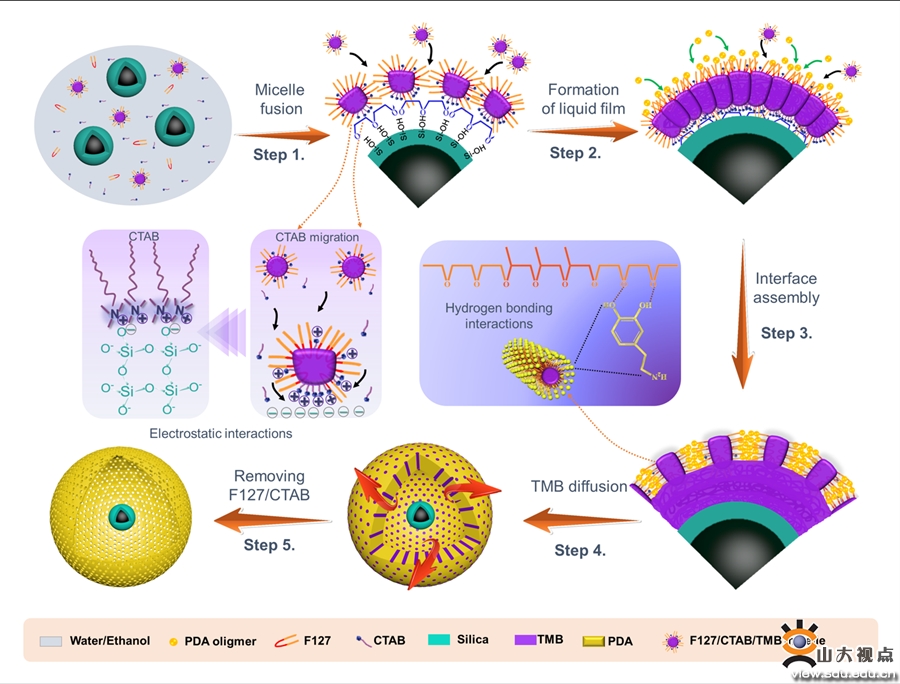
图2 YS-MMP囊泡的形成机制图
在此,作者开发了一种双模板诱导乳液辅助界面组装和聚合方法(表示为de-IAP)精准构筑了具有可调空腔尺寸的卵黄壳型磁性介孔聚多巴胺囊泡(YS-MMP)。所得YS-MMP囊泡具有可调的空腔尺寸(10 - 900 nm)、柔性介孔PDA层、大介孔孔径(21 nm)、高表面积(217.4 m2·g-1)和高磁化饱和度(31.0 emu· g-1)。PDA外壳拥有大介孔(~ 21 nm)和高表面积(217.4 m2·g-1),赋予材料高效负载(29.1 %),Cur的高包封率(41.0 %)和快速捕获细菌能力。通过调节胶体种子的浓度可以调节空腔尺寸从10 -900 nm。凭借PDA优越的光热性能和贻贝诱导的粘附性能,所制备的载Cur的YS-MMP复合材料经808 nm近红外激光照射可实现按需释放Cur,对金黄色葡萄球菌和大肠杆菌的长期光热抑制(> 99%)具有较高的细菌粘附能力。总之,开发的de- IAP方法为合理设计多功能卵黄壳介孔平台提供了新思路,有望应用于智能药物输送、生物分离、多相催化等领域。
近年来,陈景帝教授团队在生物医用材料、海洋生物活性物质、纳米仿生材料、药物载体及控缓释等方面取得了一系列重要成果,在包括Chemical Engineering Journal、Biomaterials等交叉学科领域著名期刊上发表论文90余篇。该项工作得到了国家自然科学基金、上海市科学技术委员会重点基础研究计划、中国博士后科学基金、山东省自然科学基金等的资助。
论文链接:https://doi.org/10.1016/j.cej.2023.144972