[本站讯]近日,教育部和国家卫健委心血管重构与功能研究重点实验室张澄、张运、张猛和张梅团队在心血管病基础研究领域取得系列新进展。研究成果先后发表在Nature旗下Signal Transduction and Targeted Therapy(中科院一区,最新影响因子38.104)、Nature旗下Cellular & Molecular Immunology(中科院一区,最新影响因子22.096)、美国心脏协会(AHA)会刊Hypertension(中科院一区,最新影响因子9.897)上,并被国内媒体广泛报道。
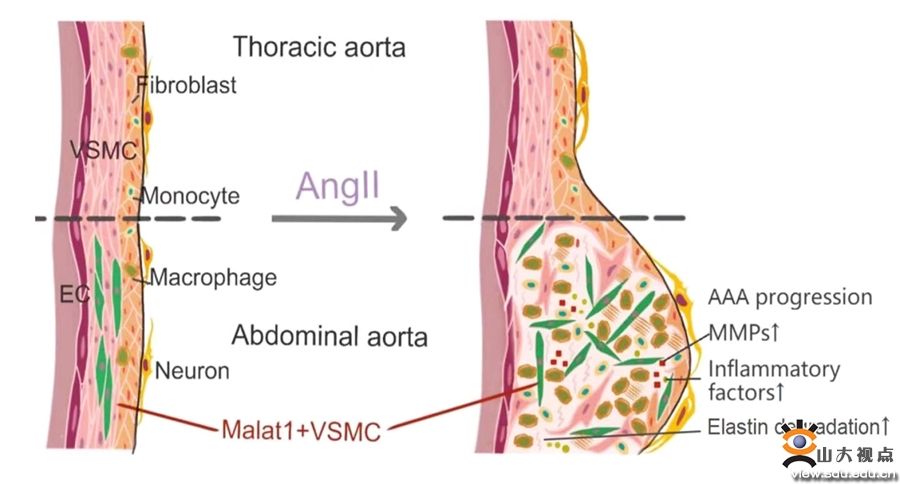
腹主动脉瘤(AAA)是一类发病率高、死亡率高、检出率低、控制率低的严重大血管疾病。AAA一旦发生破裂,死亡率高达85%—90%,但目前尚无抑制AAA的药物。深入探讨AAA的发病机制发现可有效抑制AAA病变的小分子化合物,是目前临床医学的重大课题。张澄教授和张猛教授课题组在长期的研究过程中发现,在经典的AAA小鼠模型中,动脉瘤性病变常发生在腹主动脉段而非相邻的胸主动脉段,这提示即使是解剖连续的同一条主动脉,不同位置的血管段可能存在较大的基因表达异质性,腹主动脉段可能存在易患AAA的细胞亚群或关键基因。为了证实这一科学假说,课题组根据解剖位置将主动脉进行分段单细胞测序,探讨了不同细胞亚型在主动脉节段之间的比例分布和基因表达差异。与传统的血管平滑肌细胞(VSMC)的分类不同,课题组对VSMC的组成进行了新的亚型鉴定,发现腹主动脉段上存在一种特异的Malat1+的平滑肌细胞亚群(Malat1+ VSMC4),该亚群的基因表达与细胞外基质组成和受体相互作用通路密切相关。继之,课题组针对Malat1+VSMC4亚型进行了深入研究。首先,通过荧光原位杂交(FISH)和免疫荧光共定位(IF)技术验证了Malat1+VSMC4亚型分布与单细胞数据的一致。其次,课题组构建了Malat1-/-VSMC细胞系并使用bulk-seq进行检测,发现Malat1基因敲除使VSMC的基质金属蛋白酶MMPs和炎症因子表达均显著降低。课题组进一步评估了Malat1抑制剂对AAA小鼠模型的作用,发现Malat1抑制剂不仅能有效预防AAA的发生,还可显著减缓甚至逆转AAA的发展。根据以上研究结果,课题组绘制了小鼠主动脉连续节段的完整单细胞图谱,鉴定出血管不同节段中特异性存在的细胞亚群,发现了AAA发生和发展的新机制,为AAA的临床防治提供了潜在的干预新靶点。该研究发表于国际权威期刊Signal Transduction and Targeted Therapy(中科院一区,IF:38.104)。山东大学齐鲁医院心内科博士研究生俞力雯为本文的第一作者,山东大学齐鲁医院张澄教授和张猛教授为本文的共同通讯作者。山东大学齐鲁医院为本文的第一和通讯作者单位。
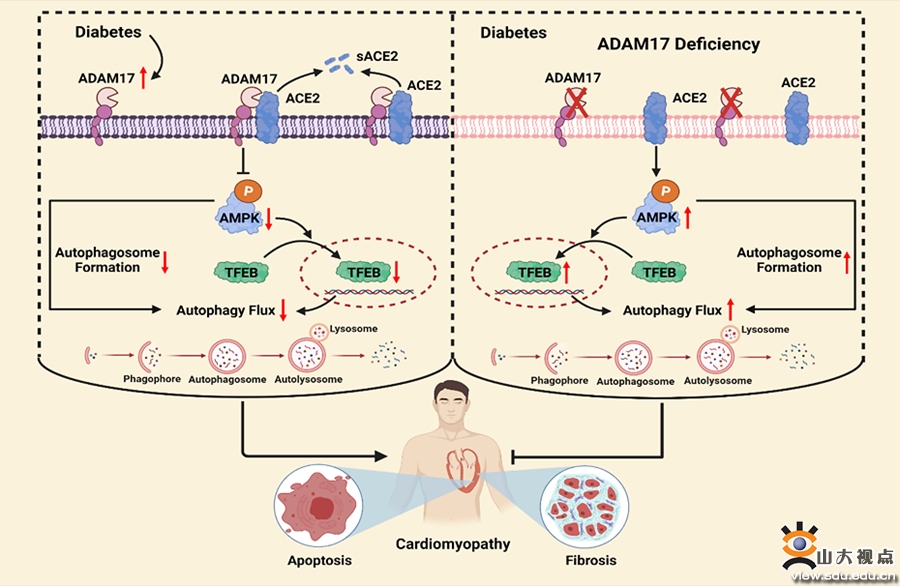
糖尿病性心肌病(DCM)是糖尿病的严重并发症,影像学表现为左室重构和收缩、舒张功能的下降,病理学表现为心肌间质纤维化、心肌细胞肥大和心肌细胞凋亡等。DCM的发病机制复杂,干预标点不明,限制了有效治疗药物的研发。解联蛋白和金属蛋白酶17(ADAM17)是1997 年发现的第一个“脱落酶”(sheddase),其功能是通过蛋白水解作用而裂解锚定于细胞膜上的一系列细胞因子、细胞粘附因子、生长因子、受体、配体和蛋白酶等。研究发现,ADAM17可裂解细胞表面的血管紧张素转化酶2(ACE2)。已知心力衰竭患者的血管紧张素II水平升高可诱导 ADAM17 活性增加,作为ADAM17底物的ACE2从细胞膜上脱落增加,血清可溶性ACE2水平上升且与心衰程度相关。然而,迄今尚无ADAM17与DCM关系的研究。为了探索ADAM17在DCM发病和发展中的作用,张澄教授、张运院士和郝盼盼教授课题组首先构建了2型糖尿病小鼠模型,发现与非糖尿病小鼠相比,2型糖尿病小鼠心肌中ADAM17的酶活性和蛋白表达显著升高而ACE2蛋白水平显著降低。免疫荧光共定位发现ADAM17在心肌细胞中高表达。继之,课题组将ADAM17flox/flox小鼠和αMHC-Cre小鼠交配繁殖,获得了心肌细胞特异性ADAM17基因敲除(A17α-MHCKO)小鼠,分别诱导同窝对照小鼠和A17α-MHCKO小鼠产生2型糖尿病。结果显示,心肌细胞特异性敲除ADAM17可显著减轻DCM小鼠的心肌纤维化和心肌细胞凋亡,改善左室收缩和舒张功能。为了深入探讨ADAM17作用的分子机制,课题组通过转录组测序研究发现,AMPK信号通路在ADAM17缺失的心肌保护作用中发挥了重要作用。心肌细胞特异性敲除 ADAM17可逆转DCM小鼠中受抑制的AMPK磷酸化水平,对于调控AMPK/mTOR及AMPK/TFEB通路起到了重要作用。进一步研究发现,ADAM17缺乏可影响自噬标志物的表达,其机制是ADAM17缺乏促进了自噬流中自噬小体的形成。在体外实验中,课题组使用原代新生大鼠心肌细胞(NRCM)和分化的H9c2细胞探讨了ADAM17的作用和分子机制,得到了与体内实验一致的研究结果。综上所述,该研究证实了在2型糖尿病小鼠心脏组织中ADAM17的活性和蛋白表达显著增加而ACE2蛋白水平显著降低,心肌细胞特异性敲除 ADAM17 可显著减轻DCM小鼠的心肌纤维化和心肌细胞凋亡,改善小鼠的心室重构和功能,其分子机制涉及ADAM17敲除后AMPK信号通路的激活和自噬小体形成的增加,从而改善了自噬流并减少了心肌细胞的凋亡。这些发现为DCM的防治提供了崭新的靶点。该研究发表于国际权威期刊Signal Transduction and Targeted Therapy(中科院一区,IF:38.104),山东大学齐鲁医院心内科博士研究生薛飞和程晶(现于北京朝阳医院工作)是该文的共同第一作者,山东大学齐鲁医院张澄教授、张运院士、郝盼盼教授为该文的共同通讯作者。山东大学齐鲁医院为第一和通讯作者单位。
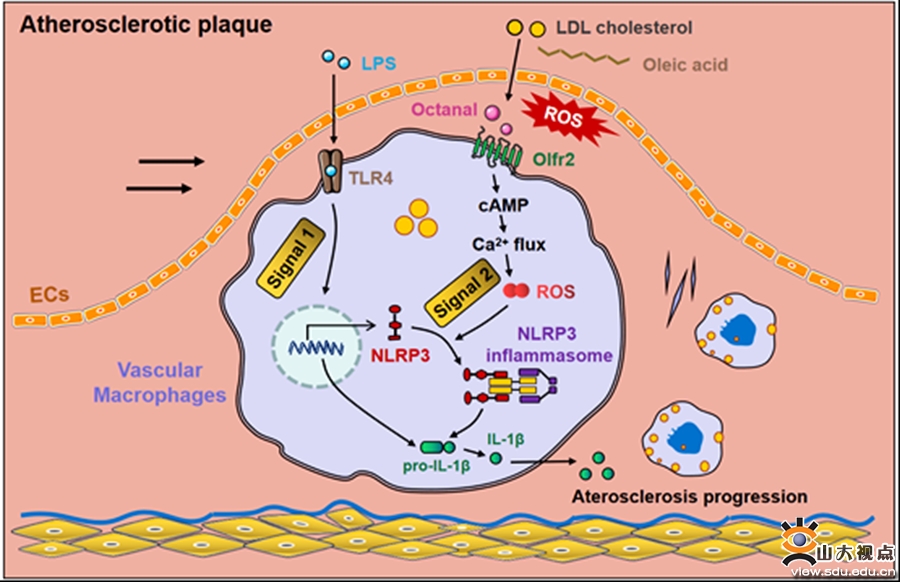
近年研究证明,动脉粥样硬化(AS)是一种动脉内膜下脂质沉积所诱发的慢性炎症性疾病,深入研究脂质—炎症“对话”机制将有助于阐明AS的发生机制并为AS的抗炎治疗提供新的靶点。近年来,张澄教授和张猛教授团队筛选出多个冠心病新的易感基因,发现了多个AS抗炎治疗的潜在靶点,如LAMP-2A、Nono、TRIM31和DRD1等,在国际权威期刊发表了系列原创性研究工作。2022年,美国加利福尼亚大学Klaus Ley教授团队在Science杂志上首次报道,血管巨噬细胞表达的嗅觉受体Olfr2可感知脂质过氧化产物——辛醛(octanal),后者激活NLRP3炎性小体并诱导巨噬细胞分泌IL-1β,进而加重AS炎症。该项研究是AS研究领域的里程碑式成果,受到国内外广泛关注。鉴于张澄教授团队近年来在AS炎症领域中的学术贡献,2022年7月4日,Nature旗下权威期刊Cellular & Molecular Immunology(中科院一区,IF:22.096)主编特邀张澄教授团队撰写针对Klaus Ley教授研究成果的评论文章(Research Highlight)。在该文中,张澄教授团队介绍了巨噬细胞Octanal-Olfr2-NLRP3/IL-1β信号通路在AS中的作用和机制,并指出了今后的研究方向:一是血管内皮细胞作为AS的第一道屏障,能否感知辛醛并启动AS的发生尚不明了;二是辛醛可能存在目前尚未证明的NLRP3炎性小体非依赖性促炎作用;三是AS斑块中仅有30%的巨噬细胞表达嗅觉受体,辛醛可能通过AS斑块中其他细胞的嗅觉受体发挥作用;四是在高辛醛水平的AS患者中,靶向抑制巨噬细胞嗅觉受体可能成为一种新的干预靶点,亟需开发嗅觉受体Olfr2的特异性抑制剂。山东大学齐鲁医院心内科博士后乔磊为该文的第一作者,山东大学齐鲁医院张澄教授和张猛教授为该文的共同通讯作者。山东大学齐鲁医院为第一和通讯作者单位。
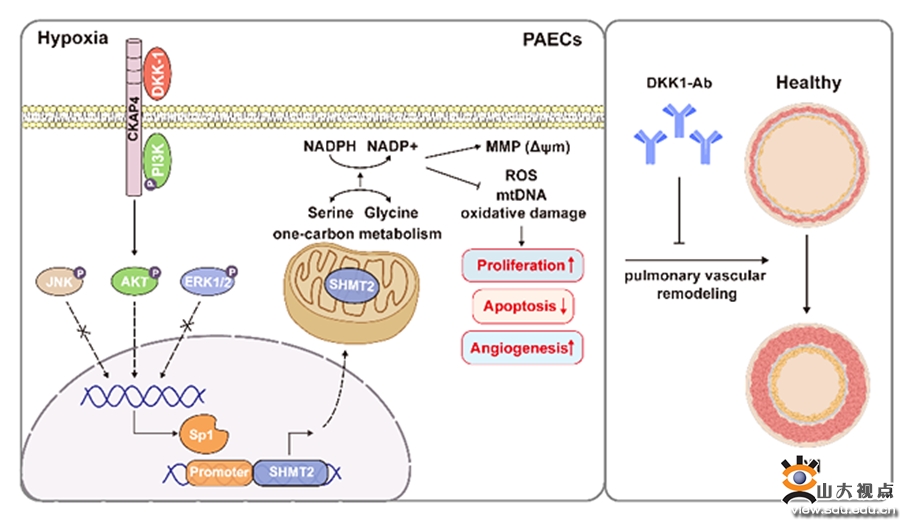
肺动脉高压(pulmonary arterial hypertension,PH)是一类以肺血管重构和肺血管阻力进行性升高为主要特征的疾病。近年来研究提示,PH是一种具有“类癌样(cancer-like)”性质的增殖性疾病,与癌症的发病机制有诸多相似之处如细胞过度增殖和凋亡耐受、生长抑制逃避、代谢重编、细胞过度迁移、内皮—间充质转化、免疫功能失调等。肺血管重构的级联事件始于内皮细胞的早期凋亡以及“抗凋亡”内皮细胞的过度增殖。DKK1蛋白,又称Dickkopf 1,是一种分泌性糖蛋白,已有研究发现DKK1可作为肿瘤诊断和预后评价的血清学标志物和治疗新靶点。张梅教授课题组在PH患者和低氧PH小鼠模型的血清及肺组织以及低氧刺激的肺动脉内皮细胞中,DKK1表达明显增高,且DKK1高表达组PH患者的平均右房压、平均肺动脉压以及肺血管阻力均明显升高。此外,免疫荧光双染显示低氧PH小鼠肺远端小动脉的DKK1表达主要定位于肺动脉内皮细胞。在此基础上,课题组构建了内皮细胞特异性敲除DKK1基因的小鼠(DKK1ECKO),通过低氧+SU5416或单纯低氧处理构建PH小鼠模型。结果显示,DKK1ECKO小鼠的肺动脉压力及肺远端小动脉血管重构明显减轻。此外,课题组发现DKK1单克隆中和抗体治疗明显改善了PH小鼠肺循环血流动力学指标及肺小动脉肌化比。为了深入研究低氧刺激下DKK1调控肺动脉内皮细胞功能的分子机制,课题组使用TMT定量蛋白质组学测序筛选出DKK1的关键下游靶点SHMT2(一碳代谢关键酶)。敲减DKK1或SHMT2后,肺动脉内皮细胞线粒体还原防御能力明显降低,线粒体ROS及线粒体DNA损伤增加,线粒体膜电位降低,从而减轻了乏氧刺激下肺动脉内皮细胞的过度增殖和凋亡抑制。此外,体内和体内的回补实验进一步证实了DKK1通过调控SHMT2而促进PH的血管重构。最后,课题组探讨了DKK1调控SHMT2转录的机制,通过双荧光素酶报告基因及染色质免疫共沉淀实验证实了DKK1通过调控Sp1促进SHMT2的转录激活。总之,本研究证实了DKK1可通过调控转录因子Sp1促进SHMT2的转录激活,进而在低氧刺激下促进了内皮细胞功能紊乱和PH的血管重构,反之,抗DKK1单克隆中和抗体治疗可逆转PH的肺血管重构,为PH的药物治疗提供了新的靶点。该研究发表于国际权威期刊Hypertension(中科院一区,IF:9.897)。山东大学齐鲁医院心内科王倩倩博士为本文的第一作者,山东大学齐鲁医院张梅教授和李萌萌主治医师为该文的共同通讯作者,山东大学齐鲁医院为第一和通讯作者单位。
相关链接:
1.An intersegmental single-cell profile reveals aortic heterogeneity and identifies a novel Malat1+ vascular smooth muscle subtype involved in abdominal aortic aneurysm formation
2.Cardiomyocyte-specific knockout of ADAM17 ameliorates left ventricular remodeling and function in diabetic cardiomyopathy of mice
3.Vascular macrophages sense octanal and drive athero-inflammation
4.Upregulation of Endothelial DKK1 (Dickkopf 1) Promotes the Development of Pulmonary Hypertension Through the Sp1 (Specificity Protein 1) /SHMT2 (Serine Hydroxymethyltransferase 2) Pathway