[本站讯]近日,山东大学药学院姜新义教授团队与美国威斯康辛大学—麦迪逊分校药学院、山东大学齐鲁医院等多家单位合作构建了一种基因纳米载体—可注射水凝胶超结构递药系统,并成功应用于恶性脑胶质瘤动物模型的术后免疫治疗。研究成果以“Intracavity generation of glioma stem cell-specific CAR macrophages primes locoregional immunity for postoperative glioblastoma therapy”为题发表于Science Translational Medicine。山东大学姜新义教授和美国威斯康辛大学-麦迪逊分校药学院Quanyin Hu教授为共同通讯作者,山东大学药学院2018级博士陈晨、齐鲁医院博士后荆卫强为第一作者,山东大学为第一作者和第一通讯作者单位。

多形性胶质母细胞瘤(GBM)是恶性程度最高的中枢神经系统肿瘤,外科手术切除是GBM病人临床治疗最基础的干预手段,GBM病人术后一般采用放疗、化疗相结合方式清除残余肿瘤细胞,而其中脑胶质瘤干细胞(GSCs)作为脑肿瘤的“种子细胞”,对放、化疗不敏感,难以清除。GBM病人手术切除实体瘤部分后,残留的GSCs很快复苏、增殖、分化,导致脑肿瘤在几个月内迅速复发。探索“特异”清除GSCs的有效策略是防止GBM术后复发的关键。
癌症免疫疗法因其突破性获得了2018年诺贝尔医学奖青睐,其中以CAR-T为代表的活细胞疗法可实现肿瘤细胞追踪定位和特异杀伤,在血液瘤中取得了令人欣喜的治疗效果。然而该方法需体外扩增T细胞,步骤繁琐且存在细胞因子“风暴”等安全性问题,且在包括GBM实体瘤中治疗效果不佳,探索更加安全高效的CAR免疫细胞疗法是GBM免疫治疗领域的重点和前沿热点。巨噬细胞(MΦ)作为固有免疫细胞,参与多种免疫相关疾病的调节,与T细胞“分泌”为主的胞毒作用不同,巨噬细胞主要起到胞吞、加工和抗原递呈作用;与T细胞相比,巨噬细胞能更好地争夺氧气和营养,活力更强。CAR-T细胞免疫疗法鼻祖、宾夕法尼亚大学Carl H. June教授近期利用腺病毒体外转导方法将CAR引入巨噬细胞,体内回输后对白血病具有显著治疗作用。外科手术切除是GBM病人临床治疗最基础的干预手段,手术所致物理创伤会在术后瘤腔周围“局部”加剧炎症因子释放,使得在术后瘤腔“局部”富集大量小胶质/巨噬细胞。由此,该研究提出假说若能“原位改造”这些小胶质/巨噬细胞生成CAR-MΦ,使其能特异性识别、吞噬GSCs,发挥抗原递呈作用,进而激活适应性免疫系统,形成免疫记忆,有望解决GSCs引起的术后GBM复发难题。
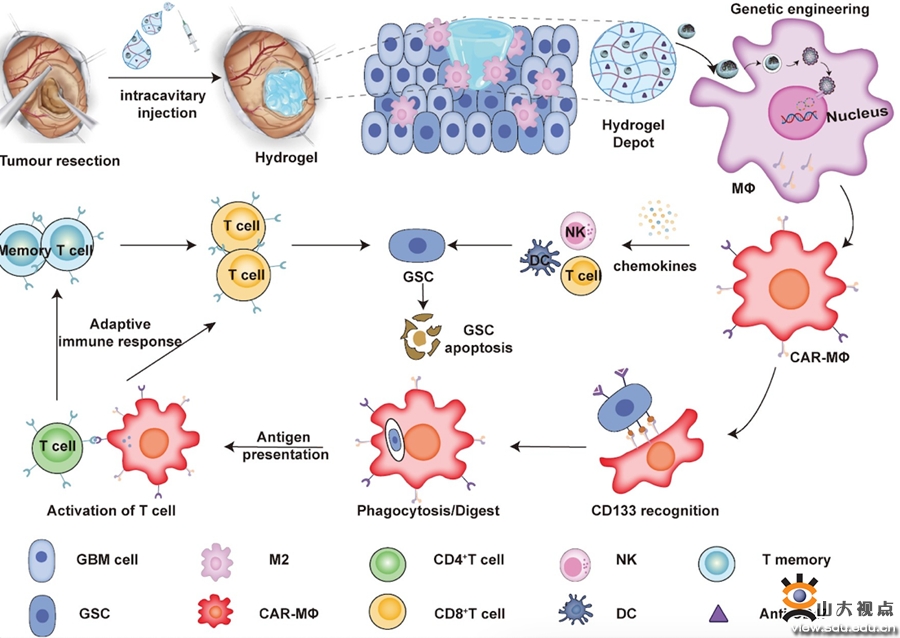
术后瘤腔周围“局部”MΦ原位CAR结构编辑及其靶向清除GSCs研究思路
该研究利用课题组开发的可注射水凝胶“药物贮库”系统,在GBM术后瘤腔内以“填充形式”共递送MΦ靶向编辑纳米载体(pCAR-NPs)和CD47抗体,对术后瘤腔周围“局部”MΦ进行原位编辑,在瘤腔周围生成可靶向清除GSCs的CAR-MΦ;同时,通过阻断肿瘤“别吃我”信号,协同增强CAR-MΦ对GSCs吞噬效率,利用其抗原递呈作用激活适应性免疫系统,清除术后残余的GSCs,形成免疫记忆,避免脑胶质瘤复发。本研究系统考察了pCAR-NPs对MΦ靶向编辑效率及关键基因影响,从细胞水平和整体动物水平验证了该杂合系统对术后瘤腔“局部”MΦ靶向编辑效率和GBM治疗效果,阐明了CAR-MΦ对GSCs特异性吞噬、抗原递呈、T细胞激活等免疫行为及潜在机制。本研究构建的纳米载体-水凝胶杂合系统可“无缝衔接”GBM病人临床治疗最基础的干预手段(手术治疗),在肿瘤的术后治疗中具有多重潜在优势:一是利用术后瘤腔设计“填充式”给药方式,患者顺应性较强;二是针对术后瘤腔周围“局部”MΦ进行CAR结构原位编辑,简化了体外编辑后系统回输这种传统操作的繁琐步骤,避免了全身给药潜在的副作用。同时,在瘤腔“一次性”给予水凝胶共载药贮库,通过水凝胶系统的缓释作用可实现术后瘤腔周围残余脑肿瘤干细胞的持久抑制;三是利用水凝胶在术后瘤腔内共递送CD47抗体,避免了CD47抗体临床试验中系统给药对红细胞的副作用,使其仅发挥阻断肿瘤细胞“别吃我”信号功能,协调增强CAR-MΦ对GSCs的吞噬效率。本研究提出的在体编辑技术为GBM的术后免疫治疗提供了新方法,有望拓宽CAR免疫细胞疗法的应用,为肿瘤干细胞特异的CAR-MΦ治疗奠定理论基础及实验依据。相关研究成果已申报发明专利3项,其中2项已获授权,目前正与相关企业进行深入合作开发研究。
近年来,姜新义教授团队在基因治疗、核酸药物可控递送等方面取得了一系列重要成果,先后发表于Nature Nanotechnology、Science Translational Medicine、PNAS、Nature Communications、Advanced Materials、ACS Nano等国际著名期刊。该研究工作得到了国家高层次青年人才项目,国家自然科学基金—国际合作(交流)重点项目、国家自然科学基金面上项目,山东省重大科技创新工程项目(2019)、山东省重大科技创新工程项目(2021)、山东大学青年交叉学科创新群体基金,山东大学齐鲁青年学者科研基金等项目支持。
文章链接:http://doi.org/10.1126/scitranslmed.abn1128