[本站讯]11月17日,高等医学研究院王培会教授团队的最新研究成果“A systemic and molecular study of subcellular localization of SARS-CoV-2 proteins”在Nature旗下期刊Signal Transduction and Targeted Therapy(IF=13.5)上发表。高等医学研究院王培会教授和美国Howard University医学院的Tang Qiyi教授为本文共同通讯作者。高等医学研究院的2020级博士生张静和Howard University医学院的Ruth Cruz-cosme为论文的共同第一作者。山东大学为第一完成单位。
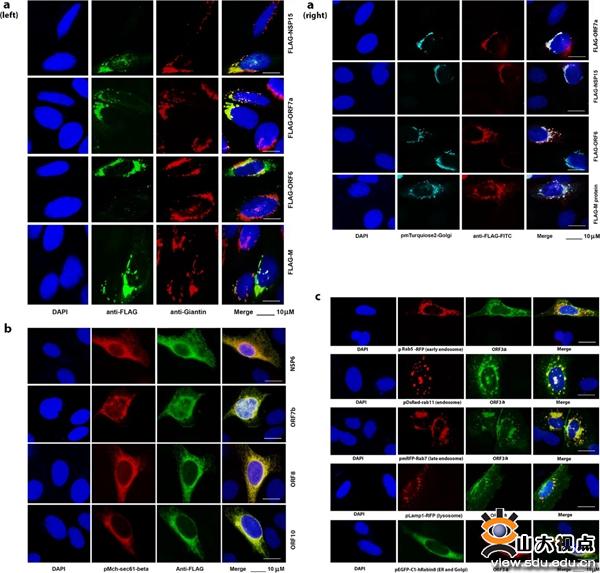
新冠病毒(SARS-CoV-2)感染导致的新冠肺炎(COVID-19)已经在全球大流行,截至2020年11月18日,已造成超过5562万人感染,累计死亡病例超过133万人,严重危害人类的健康,对公共卫生安全和经济发展造成了前所未有的威胁。新冠病毒基因组编码大约29个蛋白,了解这些蛋白的亚细胞定位不仅对理解新冠病毒与宿主细胞的相互作用具有重要启发作用,而且可以为抗病毒药物的开发提供线索。本研究利用免疫荧光等方法系统的阐明了除NSP11蛋白外(仅有14个氨基酸)的28个新冠病毒蛋白的亚细胞定位。
实验结果表明,大部分新冠病毒蛋白定位在细胞质中,一些新冠病毒蛋白同时具有细胞质和细胞核定位,4个新冠病毒蛋白M、NSP15、ORF6、ORF7a检测到在高尔基体(Golgi apparatus)上,ORF3a定位在内体(endosome)和溶酶体(lysosome)中,NSP6、ORF7b、ORF8和ORF10定位在内质网(endoplasmic reticulum)中。考虑到M蛋白不是唯一的高尔基体定位蛋白,因此,除了M蛋白外的其他病毒蛋白如NSP15、ORF6和ORF7a可能也参与了结构蛋白E和S的成熟。ORF3a与内体蛋白Rab5、循环利用内体蛋白Rab11、参与早期内体向晚期内体转运的蛋白Rab7以及溶酶体蛋白Lamp1存在共定位,这表明ORF3a参与了最终引起内体和溶酶体融合的内吞过程,因此,ORF3a有可能参与了细胞内有毒物质的自我清除并且促进SARS-CoV-2复制。本研究为了解新冠病毒蛋白的功能和抗病毒药物的研发提供了重要依据。

该研究得到了山东大学新冠肺炎应急攻关科研专项 (2020XGB03, P.-H.W)和美国NIH R01等项目的 (Q.T.) 的支持。
原文链接:https://www.nature.com/articles/s41392-020-00372-8