[本站讯]近日,化学与化工学院佟振合院士团队徐政虎课题组在复杂多环可控选择性合成的研究中取得突破进展,相关论文以“Asymmetric Synthesis of a Fused tricyclic Hydronaphthofuran Scaffold by Desymmetric [2+2+2] Cycloaddition”为题,在线发表于化学国际权威期刊《德国应用化学》 (Angew. Chem. Int. Ed., DOI:10.1002/anie.201911071)。化学院2018级博士生滕琪为本文第一作者,徐政虎教授为通讯作者,山东大学化学与化工院为第一通讯单位。
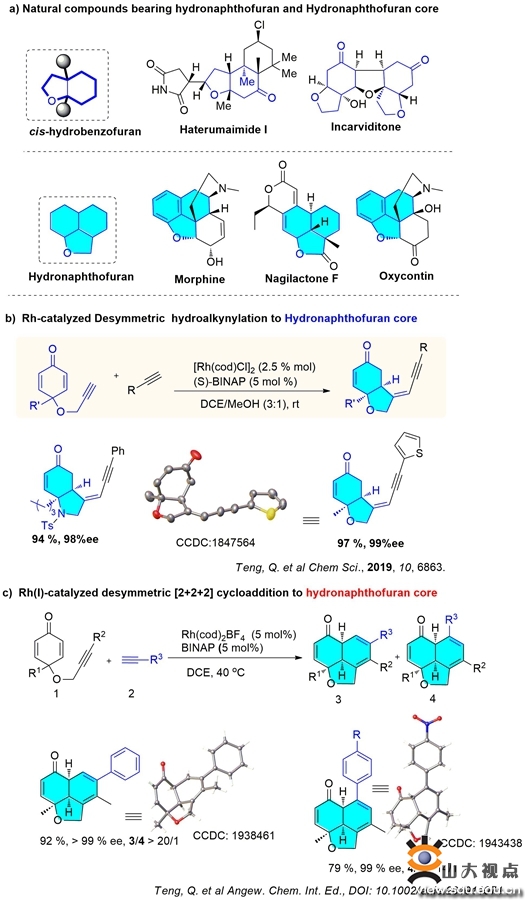
许多具有生物活性的天然产物以及药物分子中均含有复杂的多元并环体系(图a),典型的手性双环如顺式氢化苯并呋喃结构,手性三环如氢化萘并呋喃骨架。大家熟知的吗啡、止疼药奥施康定等均含有类似的复杂并三环体系。传统合成这些双环/三环骨架的方法通常需要多步反应,效率比较低,并且在这些多步反应中建立多个手性中心亦具有较大的挑战。因此,如何通过不对称催化反应一步实现这种稠双环/三环骨架的高选择性可控合成,一直是合成化学家面临的挑战。
今年初,徐政虎课题组采用Rh催化的去对称化反应实现了端炔对1,6-烯炔的串联加成环化反应,一步高效构建双环氢化苯并呋喃产物(图b)。两种端炔的选择性二聚反应,理论上可以产生12种异构体,该催化体系实现了对反应化学、区域、非对映以及对映选择性的完美控制,高选择性地得到了单一加成产物(Chem.Sci.2019,10, 6863)。
在前期工作的基础上,课题组通过对烯炔底物结构的调整、反应条件的进一步优化,发现采用内烯炔底物与端炔反应,在Rh催化剂的条件下,一步可以构建具有三个连续立体中心的三环氢化萘并呋喃骨架(图c)。该反应具有100%的原子经济性、非常高的对映选择性、良好的底物普适性以及温和的反应条件等优点,进一步加入碱引发1.5-H迁移反应即可以合成得到手性三环五取代的苯衍生物。
以上研究工作得到了国家自然科学基金、山东大学学科建设经费、交叉学科项目等经费的支持,山东大学结构成分与物性测量平台为本工作的顺利开展提供了关键支持。
论文链接:https://onlinelibrary.wiley.com/doi/pdf/10.1002/anie.201911071