[本站讯]近日,山东大学基础医学院膜受体药物研究团队孙金鹏教授课题组在GPCR信号转导研究中取得新进展,研究成果“Allosteric mechanisms underlie GPCR signaling to SH3-domain proteins through arrestin”8月17日在线发表于《Nature Chemical Biology》(1区期刊,5年影响因子IF: 13.99)。山东大学为论文第一单位,基础医学院生理学系博士生杨帆,生物化学与分子生物学系讲师肖鹏、博士生屈昌秀,生理学系博士生刘琪为该论文共同第一作者。基础医学院孙金鹏教授和中国科学院生物物理研究所王江云研究员为论文的共同通讯作者。
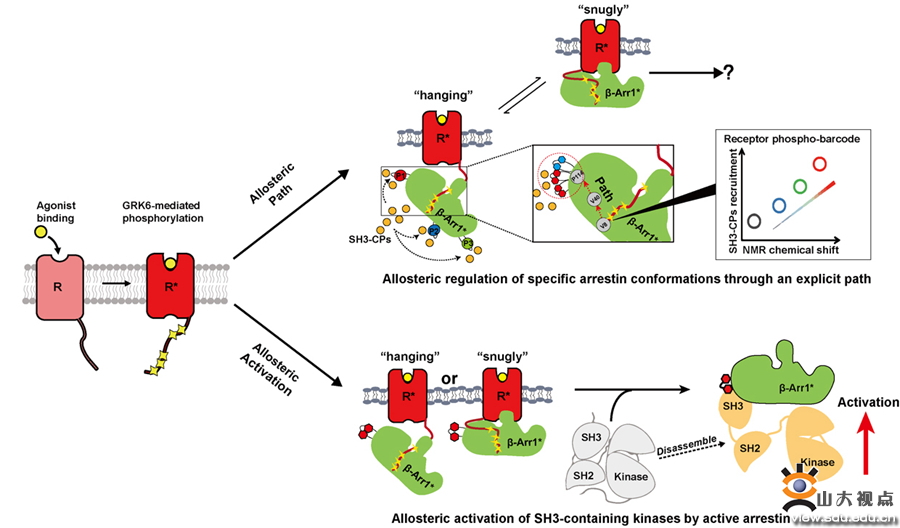
G蛋白偶联受体(GPCR)参与调解生命活动中大部分的生理过程,其功能异常是导致很多疾病发生的关键因素,因此是一类重要的药物靶位点。虽然GPCR具有极其重要的功能,但其信号转导的规律还没完全阐释清楚。本研究系统阐释了800多个GPCR与下游含有SH3结构域的近300个蛋白(SH3-domain containing proteins,SH3-CPs)之间的信号转导规律,不仅发现重要信号转导分子Arrestin的3个多聚脯氨酸是GPCR联系下游SH3结构域蛋白的停靠码头(docking sites),还发现别构调控是介导Arrestin与下游SH3结构域蛋白的主要机制,打破了旧的观念,即Arrestin只具有接头蛋白(adaptor)的功能。
在该研究中,研究团队利用19F-NMR、多种基因密码子扩展以及化学标记等手段对GPCR与SH3-CPs之间的作用机制进行了深入细致的研究。文章利用19F-NMR、细胞及生化实验发现,GPCR的磷酸化编码可以精确调控β-arrestin-1的构像变化,使其三个PRs发生构象改变,进而招募下游的SH3-CPs,调控下游的信号转导,并具有显著的受体以及磷酸化编码的特异性。其中,GPCR磷酸化编码介导的β-arrestin-1构象变化与其招募SH3-CPs的效价成相关性。同时,研究组精确找到了这种别构调控信号传递的路径。研究团队继而利用19F-NMR弛豫实验找到了SRC、FYN、PLCr与β-arrestin-1结合区域。另外,研究组利用体外重构实验、荧光淬灭及BRET方法证明GPCR与β-arrestin-1复合物能够激活下游的SH3-CPS,如SRC,其作用机制也是通过别构调控作用完成的。最终本研究揭示了GPCR与SH3-CPs之间的作用机制,主要包含两个层面的别构调节,第一是通过GPCR磷酸化编码,别构调控arrestin,进而招募不同的SH3-CP,传递下游信号。第二个层面是GPCR与arrestin复合物可以与SH3-CPs蛋白如SRC蛋白结合,通过别构调控机制将其激活,发挥其下游生理功能。已发表的这篇工作是前期团队提出的磷酸化编码的笛子模型(Nat Commun. 2015 Sep 8;6:8202.),以及重要心血管事件(Nat Commun.2017 Feb 9;8:14335.)(Nature Commun.2018 Jan 2;9:11.)工作的进一步拓展和理论更新。以上研究得到了国家自然科学基金和山东省杰出青年基金资助。
文章链接:
“Allosteric mechanisms underlie GPCR signaling to SH3-domain proteins through arrestin”